بقلم: عبير غانم
الرؤية هي نافذتنا على العالم؛ إنها الحاسة الثمينة التي تُمكننا من استكشاف جمال الألوان والتفاصيل المحيطة بنا. ومع ذلك، يعيش ملايين الأشخاص في ظلام تام أو يعانون من تحديات كبيرة في الرؤية. اكتشف العلماء في الدراسة الآتية أنَّ الأسماك تتميز بنظامها البصري المتقدم وقدرتها على تجديد الأنسجة العصبية المتضررة، بما في ذلك الأنسجة المتعلقة بالرؤية. تختلف عيون الأسماك تمامًا عن عيون البشر، إلا أنها تحتوي على آليات فريدة يمكن أن تفيدنا في فهم وعلاج العمى البشري، وهو تطور مذهل يجعلنا ننظر إلى المستقبل بتفاؤل وأمل جديدَيْن.
آلية الرؤية عند البشر
نعلم أنَّ أعيننا مجرد كواشفَ للضوء؛ حيث يجب أن تصل محفزات الضوء إلى الدماغ لتتم معالجتها كصورة نتصورها بالفعل عبر العصب البصري. وفي أمراض مثل اعتلالات الأعصاب البصرية، تنشأ الإصابة بالعمى تدريجيًا نظرًا لعدم قدرة البشر على تجديد الأعصاب في نظامهم العصبي المركزي. وعلى النقيض من ذلك تمامًا، نجد أنَّ البرمائيات (مثل الضفادع والسمَندَل) أو الأسماك يمكنها تجديد العصب البصري في أقل من 12 يومًا، واستعادة بصرها بعد نحو 80 يومًا من الإصابة.
مرض «فقد البصر الوراثي» (LCA)
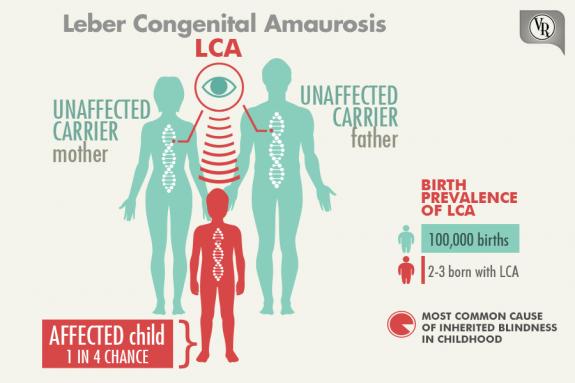
يُطلق عليه اسم «فقدان البصر الخلقي لليبر» (Leber’s Congenital Amaurosis)، نسبةً إلى الطبيب «ثيودور ليبر» (Theodore Leber) الذي شخَّصه للمرة الأولى، وهو نوع نادر من اضطراب العين الوراثي يتسبب في فقدان تدريجي للرؤية منذ الولادة، ويصيب من 2 إلى 3 بين كل مئة ألف مولود. وهو مرض وراثي متنحي الصفة (Recessive Trait)؛ أي أنه يجب أن يكون للفرد نسختان من الجين المَعيب لظهور الصفة المتنحية. وإذا كان كلٌ من الوالدين حاملًا للجين المَعيب وهما ليسا مصابيْن بالمرض، فإن هناك فرصة بنسبة 25% لأن يرث الأطفال الجين المَعيب من كلا الوالدين، وبذلك تظهر الصفة المتنحية (مرض LCA).
تم تحديد نحو 24 جينًا مرتبطًا بـمرض (LCA)، وأحد هذه الجينات هو جين يسمى (AIPL1 – Aryl Hydrocarbon Receptor Interacting Protein-Like 1). ويحدث المرض نتيجةً لطفرة في «الحمض النووي» (DNA) لأحد هذه الجينات، حيث تؤثر هذه الطفرة على التطور الطبيعي للعين. وبالحديث عن طبيعة العين، فإن الشبكية الطبيعية أو السليمة هي الطبقة الرقيقة من الأنسجة -الموجودة في الجزء الخلفي من العين- التي تستجيب للضوء وتميز الألوان وتنقل المعلومات إلى الدماغ عبر العصب البصري، وتحتوي عادةً على خلايا حساسة للضوء تسمى «المخاريط والقضبان» (Cones and Rods).
تستقبل المخاريط الإشارات الضوئية الساطعة وتساعد في تمييز الألوان، بينما تُستخدَم القضبان في تلقي الإشارات الضوئية الخافتة، وهي غير قادرة على تمييز الألوان لأنها أحادية اللون (Monochrome)، وهذا هو السبب في أننا نرى بالأبيض والأسود أثناء الليل. وفي حالة مرض (LCA)، تكون هذه المخاريط والقضبان مشوهة أو مفقودة لدى المريض، مما يُعيق قدرته على استقبال الضوء.
الدراسات على «أسماك الزرد» (Zebrafish)
كشف باحثو وحدة علم الأعصاب في المعهد الياباني «أوكيناوا للعلوم والتكنولوجيا» (OIST) عن متلازمةٍ مماثلة في أسماك الزرد -كونها نموذجًا حيوانيًا يمكن استخدامه لدراسة السمات والأمراض الوراثية البشرية- نظرًا لأنها تتشارك مع البشر بنسبة 70% من الشفرة الجينية.
وقد اكتشفوا من خلال دراسة أجنة أسماك الزرد المتحورة وراثيًا التي تفتقر إلى الاستجابة للمنبهات البصرية أنَّ الحمض النووي لأسماك الزرد يحتوي على جينين من نوع (Aipl1) هما (Aipl1a) و(Aipl1b)، وهما مسؤولان عن نشاط القضبان والمخاريط على التوالي. فعند حدوث طفرة جينية في تسلسل الحمض النووي (Aipl1b)، يفقد الجين (Aipl1) نشاطه الخاص بمستقبلات الضوء المخروطية، لذا تُظهِر المستقبلات الضوئية المخروطية شكلًا تشريحيًا مشوهًا. ومع ذلك، لا تتأثر القضبان. يشير البحث إلى أنَّ الجين (Aipl1b) مهمٌ للوظائف البصرية والمستقبلات الضوئية المخروطية في أسماك الزرد، وبدونه لا تستقبل المخاريطُ منبهاتِ الضوء وتتدهور أثناء التطور، وهذا مؤشرٌ يساعد على علاج المرض في البشر.
زاد فضول «جيمس باتون» (James Patton) وفريقه -في قسم العلوم البيولوجية بـ«جامعة فاندربيلت» (Vanderbilt University) بالولايات المتحدة- حول كيفية بدء تجديد شبكية عين أسماك الزرد بالضبط، وفكروا في دراسة الناقل العصبي (GABA)، وهو ناقل كيميائي في الدماغ يقلل من نشاط الخلايا العصبية، كما أنه يتحكم في نشاط الخلايا الجذعية في أدمغة الفئران. وقد خطرت لهم هذه الفكرة استنادًا إلى اعتقاد الدراسات السابقة بأنَّ المستقبلات الضوئية المعطوبة في عيون الأسماك قد تفرز عواملَ أو محدداتِ نموٍ تؤدي إلى تنشيط الخلايا الجذعية في العين لبدء التمايز إلى خلايا شبكية جديدة.
اختبر الفريق الفكرة على مجموعتين من أسماك الزرد؛ تتكون المجموعة الأولي من أسماك عمياء وضعوها في الظلام لبضعة أيام، ثم عرَّضوها للضوء الساطع وأعطوها أدويةً تحفز الناقل العصبي (GABA). وتتكون المجموعة الثانية من أسماك زرد ترى بطريقة طبيعية أعطوها عقاقيرَ لخفض مستوى الناقل العصبي (GABA). وقد وجدوا أن الأسماك العمياء التي تلقت الأدوية المُنشطة للناقل العصبي (GABA) لم تتمكن من تجديد شبكية العين بطريقة طبيعية، بينما بدأت الأسماك الأخرى ذات مستويات (GABA) المنخفضة في تجديد شبكية العين.
ويشير هذا إلى أن تركيز الناقل العصبي (GABA) المنخفض هو الذي تسبب في بدء عملية تجديد شبكية العين. وقد بدأ الفريق في اختبار نظرية (GABA) على الفئران بالفعل، وإذا نجح ذلك فستُجرى التجارب على البشر لقياس فاعليتها.
ومع أنَّ العلاج الجيني متاح حاليًا لحالات العمى الوراثي المرتبطة بطفرتين في الجين (RPE65) الذي يتسبب في إصابة نحو 6% من حالات (LCA)، تحمل هذه المخلوقات الصغيرة في طياتها أملًا كبيرًا للبشرية لفهم آليات المرض وتطوير علاجات جديدة. إنَّ تقدم العلم في هذا المجال قد يجعل العمى الوراثي مجرد ذكرى تتلاشى أمام تطور العلاجات الجينية لاستعادة القدرة على الإبصار.
المصادر:
https://www.ucsfhealth.org/conditions/leber-congenital-amaurosis-lca
https://www.vailranchpharmacy.com/blog/what-leber%E2%80%99s-congenital-amaurosis-lca
https://bionomous.ch/articles/what-are-zebrafish/
https://www.oist.jp/news-center/press-releases/fish-eyes-help-understand-human-inherited-blindness-0
https://www.smithsonianmag.com/innovation/could-tiny-zebrafish-teach-us-cure-blindness-180962626/