بقلم: فاطمة الزهراء عبد المجيد
تحدثنا في المقال السابق عن تغير المناخ، وكيف أنه بالغ التأثير على الأسماك من خلال ارتفاع درجات الحرارة وتحمُّض المحيطات ونقص الأكسجين. ونحن في هذا المقال بصدد الحديث عن استجابة الأسماك لتلك التغيرات البيئية.
التكيف الجيني والمرونة المظهرية
عند الحديث عن استجابة الكائنات الحية للتغيرات البيئية، ينبغي علينا أن ننظر إليها من زاوية تطورية. ذلك بأن تلك التغيرات تحدث عبر أجيال من النوع الواحد (1). وتواجه الكائناتُ الحية التغيراتِ البيئية السريعة بثلاث إستراتيجيات: الأولى هي البقاء في مكانها وتحمل الظروف المحلية، والثانية هي التكيف عن طريق المرونة المظهرية أو التغيير الجيني، والثالثة هي تغيير أماكنها وتوزيعاتها الجغرافية (2).
وسوف نجعل تركيزنا في هذا المقال على الإستراتيجية الثانية التي تؤدي إلى تأقلم الكائنات بـ«المرونة المظهرية» (Phenotypic Plasticity) أو إلى تكيفها عبر الانتخاب الطبيعي على مستوى الجينات (التطور) (3). ويشار هنا إلى أن المرونة المظهرية والتكيف الجيني لا يستبعد أحدهما الآخر (4)؛ فالمرونة تيسر التغير التطوري التكيفي أو تعيقه استجابةً لتغير البيئة، كما أن حجم المرونة المظهرية واتجاهها بإمكانهما التطور استجابةً للانتخاب الطبيعي (5).
والفارق بين المرونة المظهرية وبين التكيف الجيني هو أن الأولى تسمح للنمط الجيني الواحد بأن يتمظهر في عدة أنماط في ظل بيئات مختلفة، بينما التكيف الجيني يتضمن «تمايزًا جينيًا» (Genetic Differentiation) (6) خاصًا بكل بيئة (7). وتنقسم المرونة المظهرية إلى قسمين:
- المرونة النمائية: وهي التي تُستحَث من خلال الأمشاج الأبوية والبيئة الجنينية للنسل.
- المرونة الانعكاسية: وهي التي يُظهِرها الكائن الحي خلال حياته فيما يُسمَّى بـ”التأقلم” (8).
استجابة أسماك الشعاب المرجانية لتغير المناخ
- المرونة المظهرية
أسماك الشعاب المرجانية من أكثر الكائنات حساسيةً لتغير المناخ نظرًا لعيشها قرب حدودها الحرارية، وخصوصًا تلك التي تعيش في المسطحات المائية الاستوائية (3). ويُعرَّف «الحد الحراري» (Thermal Limit) على أنه مدى درجات الحرارة التي يمكن للكائنات الحية تحمُّلها عند التعرض لها لمدة قصيرة، ويقل عندها «الأداء الوظيفي الأمثل» للكائنات (Performance Optima) (9).
وتعود أصول أسماك الشعاب المرجانية إلى عصور جيولوجية ذات درجات حرارة وتركيزات من ثاني أكسيد الكربون أعلى من نظائرها الحالية (10)، لذا فمن المفترض أنها قادرة على التأقلم مع التغيرات المتوقعة (11)، وذلك من خلال مقدرتها على تنظيم التركيزات الحمضية-القاعدية للأيونات، وكذلك ضمان وصول الأكسجين إلى الأنسجة في بيئة ذات تركيزات عالية من ثاني أكسيد الكربون (12).
وللمفارقة، فإن للحفاظ على وظائف الأعضاء لأسماك الشعاب المرجانية ضريبةٌ تدفعها الأنظمة الحسية والاستجابة السلوكية لتلك الأسماك، ومن المرجَّح أن ذلك يحدث نتيجة للارتباط بين التركيزات الأيونية الحمضية-القاعدية وبين وظيفة الناقل العصبي (GABA-A) (3).
وتقترح دراسة أخرى أن بإمكان أسماك الشعاب المرجانية أن تتأقلم من خلال المرونة المظهرية العابرة للأجيال (13) عن طريق آليات فوق جينية تعمل على الصفات المتعلقة بعمليات الأيض (14)، ويعزز ذلك من احتمالية تكيف «النطاق التنفسي/الهوائي» (Aerobic Scope) لديها مع درجات الحرارة العالية، بينما يتقلص حجم أجسادها ضريبة لذلك (14).
وفي دراسة تتبَّعت التغيرات التي تحدث في أنسجة أسماك الشعاب المرجانية للتأقلم مع ارتفاع درجات الحرارة، لاحظ العلماء اختلافًا بين أنواعها في بداية تأقلمها (15)؛ فالنوع (C. cuning)أظهر تأقلمًا ملحوظًا منذ الأسبوع الأول للتعرض لدرجات الحرارة، بينما أظهر النوع الثاني (C. quinquelineatus)تأقلمًا متأخرًا وأقل من النوع الأول، كما ظهرت وفيات بين أعداده بنسبة 79% في الأسبوع الأول، مما يشير إلى اختلاف درجة التأقلم باختلاف صفات النوع؛ فالأول نشيط ومتحرك، والثاني ثابت في مكانه. ويعود ذلك في الأغلب إلى «التطور المتباعد» للنوعين (Divergent Evolution) (15).
- التكيف الجيني التطوري
أما بالنسبة للتكيف الجيني، فإن التماثل في “درجات الحرارة المُثلى” للنطاق الهوائي بين مجموعات الأسماك الاستوائية وتلك التي تقبع عند خطوط العرض العليا- يشير إلى أنه لم يكن هناك “تكيف محلي” قوي مع البيئات الحرارية لتلك الأسماك (16). والنطاق الهوائي هو الفرق بين المعدل الأعلى والأقل لاستهلاك الأكسجين لدى الحيوانات في حالة الراحة (17). ويقل النطاق الهوائي حين تقل درجة الحرارة أو ترتفع عن درجة معينة. وعند ارتفاع درجات الحرارة، تقلل الحيوانات من الطاقة المستهلَكة في التغذية والتكاثر، فتقل لياقتها (17). وتكون درجة الحرارة حرجة (مميتة) عندما يستهلك الحيوان السعة القصوى للأكسجين لديه في تلبية احتياجاته التنفسية الأساسية. ووفقًا لذلك، فالنطاق الهوائي يعبر عن قدرة الحيوان على تعزيز لياقته في بيئته أكثر من مجرد الحفاظ على الأداء الأساسي (18).
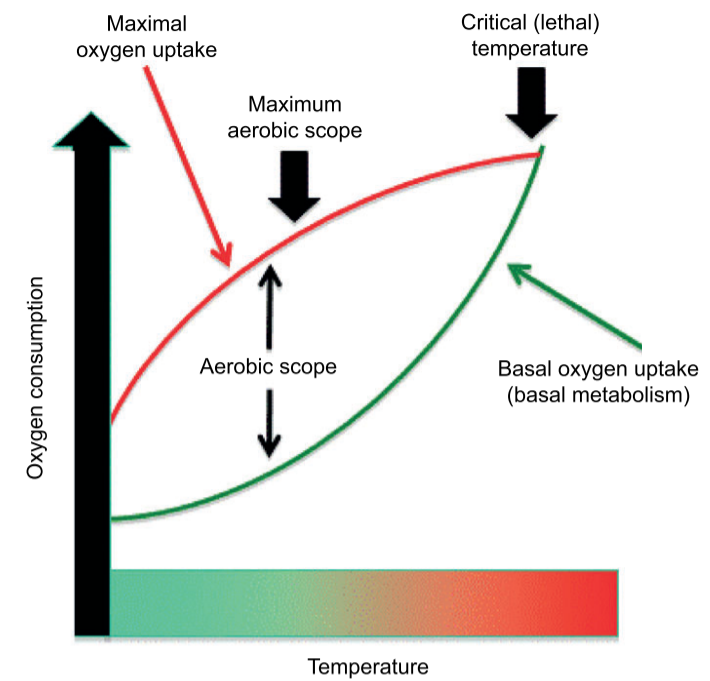
يتفق هذا مع دراسة أخرى تستبعد احتمالية التكيف التطوري للأسماك المدارية التي تعيش قرب حدودها الحرارية (19). وفي دراسة حديثة، لاحظ العلماء أن أسماك الشعاب المرجانية في الخليج العربي أقل تنوعًا ووفرة من نظيراتها في خليج عُمان، مما يدل على أن الظروف البيئية القاسية تؤدي إلى تدهور «التنوع البيولوجي» (Biodiversity) لأسماك الشعاب المرجانية و«إنتاجيتها» (Productivity). وبالتبعية، فإن قلة التنوع البيولوجي وجه آخر لقلة «التنوع الجيني» (Genetic Variation) الضروري للتكيف عن طريق الانتخاب الطبيعي (20).
لكن، وبرغم ذلك، هناك بصيص من الأمل لأسماك الشعاب المرجانية للتكيف عبر قوى تطورية أخرى بجانب الانتخاب الطبيعي، حيث تقترح دراسة أخرى أن بعض أنواع أسماك الشعاب المرجانية بإمكانها التكيف الجيني عبر «الانحراف الوراثي» (Genetic Drift) والانعزال الجغرافي (21)، والبعض الآخر عبر الانتخاب الطبيعي (22).
وفي دراسة حديثة شملت نوعًا من أسماك الشعاب المرجانية يُدعَى «شقائق النعمان» واسمه العلمي (A. melanopus)، لاحظ العلماء «تغيرات في الجينات النمائية» (Ontogenetic Changes) ليرقات الأسماك والتي تعبر عن البروتينات المرتبطة بالأكسجين، ومن المرجَّح أن هذه التغيرات هي المسؤولة عن التغيرات الفسيولوجية اللازمة لليرقات لاستقطابها إلى الشعاب المرجانية (23)، وذلك لأن اليرقات تحتاج إلى قدرة عالية على السباحة في مواجهة تيارات المحيط حتى تصل إلى الشعاب المرجانية، ومن ثمَّ عليها أن تغير من وظائفها الحيوية بسرعة كافية لتتكيف مع نقص الأكسجين ليلًا في بيئتها الجديدة (24).
الخلاصة
لقد طورت الأسماك عبر تاريخها التطوري إستراتيجيات عديدة للتعامل مع التغيرات المناخية والبيئية التي تتعرض لها، ومن بينها أسماك الشعاب المرجانية التي يتراوح عدد أنواعها ما بين 6000 إلى 8000 نوع (25). وحيث تعود أصولها لأكثر من 66 مليون عامًا (26)، فقد استطاعت أن تواجه درجات حرارة أقسى من درجات الحرارة الحالية وتركيزات أعلى من التركيزات الحالية لثاني أكسيد الكربون. ومن خلال المرونة المظهرية والتكيف الجيني، تحاول أسماك الشعاب المرجانية أن تواجه التحديات المناخية الحالية التي ستتفاقم آثارها في العقود القادمة. وفي النهاية، ربما تستطيع أنواعٌ من هذه الأسماك الصمود أمام تلك التحديات، وربما لا يستطيع البعض الآخر ذلك.
المصادر:
1) Baltar F, Bayer B, Bednarsek N, Deppeler S, Escribano R, Gonzalez CE, Hansman RL, Mishra RK, Moran MA, Repeta DJ, et al. 2019. Towards Integrating Evolution, Metabolism, and Climate Change Studies of Marine Ecosystems. Trends in Ecology & Evolution. 34(11):1022–1033.
2) Gienapp P., Teplisky C., Alho J. S., Mills J. A., Merilä J. 2007. Climate Change and Evolution: Disentangling Environmental and Genetic Responses. Mol. Ecol. 17, 1–12.
3) Rummer JL and Munday PL. 2016. Climate change and the evolution of reef fishes: past and future. Fish and Fisheries. 18(1):22–39.
4) Kingsolver Joel G. and Buckley Lauren B. 2017. Evolution of plasticity and adaptive responses to climate change along climate gradients. Proc. R. Soc. B.284:20170386
5) Martin R, Carmen, Moore MP, Diamond SE. 2023. When will a changing climate outpace adaptive evolution? WIREs climate change. e852.
6) Verity R, Nichols R A. 2014 What is differentiation, and how should we measure it –GST, D, neither or both? Molecular Ecology. 23(17): 4216-4225.
7) Acasuso-Rivero C, Murren CJ, Schlichting CD, Steiner UK. 2019 Adaptive phenotypic plasticity for life-history and less fitness-related traits. Proc. R. Soc. B 286:20190653.
8) Beaman JE, White CR and Seebacher F. 2016. Evolution of Plasticity: Mechanistic Link between Development and Reversible Acclimation. Trends in Ecology & Evolution. 31(3):237–249.
9) Physiological Optima and Critical Limits | Learn Science at Scitable.
10) Delrieu‐Trottin E, Hubert N, Giles EC, Chifflet‐Belle P, Suwalski A, Neglia V, Rapu‐Edmunds C, Mona S, Saenz‐Agudelo P. 2020. Coping with Pleistocene climatic fluctuations: Demographic responses in remote endemic reef fishes. Molecular Ecology. 29(12):2218–2233.
11) Munday PL, McCormick MI and Nilsson GE. 2012. Impact of global warming and rising CO2 levels on coral reef fishes: what hope for the future? Journal of Experimental Biology. 215(22):3865–3873.
12) Rummer JL, Stecyk JAW, Couturier CS, Watson S-A, Nilsson GE, Munday PL. 2013. Elevated CO2 enhances aerobic scope of a coral reef fish. Conservation Physiology. 1(1):cot023.
13) Oomen RA and Hutchings JA. 2017. Transcriptomic responses to environmental change in fishes: Insights from RNA sequencing. Miller KM, editor. FACETS. 2(2):610–641.
14) Munday PL, Donelson JM and Domingos JA. 2016. Potential for adaptation to climate change in a coral reef fish. Global Change Biology. 23(1):307–317.
15) Johansen JL, Nadler LE, Habary A, Bowden AJ and Rummer J. 2021. Thermal acclimation of tropical coral reef fishes to global heat waves. eLife. 10.
16) Gardiner NM, Munday PL and Nilsson GE (2010) Counter-Gradient Variation in Respiratory Performance of Coral Reef Fishes at Elevated Temperatures. PLOS ONE 5(10): e13299.
17) Munday PL, McCormick MI, Nilsson GE. 2012. Impact of global warming and rising CO2 levels on coral reef fishes: what hope for the future? Journal of Experimental Biology. 215(22):3865–3873.
18) Eliason EJ, Wilson SM, Farrell AP, Cooke SJ and Hinch SG. 2013. Low cardiac and aerobic scope in a coastal population of sockeye salmon Oncorhynchus nerka with a short upriver migration. Journal of Fish Biology. 82(6):2104–2112.
19) Morgan R, Finnøen MH, Jensen H, Pélabon C, Jutfelt F. 2020. Low potential for evolutionary rescue from climate change in a tropical fish. Proceedings of the National Academy of Sciences. 117(52):33365–33372.
20) Hvilsom C, Segelbacher G, Ekblom R, Fischer MC, Laikre L, Leus K, O’Brien D, Shaw R, Sork V. 2022. Selecting species and populations for monitoring of genetic diversity. IUCN.
21) Torquato F, Range P, Radhouane Ben-Hamadou, Eva Egelyng Sigsgaard, Philip Francis Thomsen, Riera R, Berumen ML, Burt JA, Feary DA, Marshell A, et al. 2019. Consequences of marine barriers for genetic diversity of the coral‐specialist yellowbar angelfish from the Northwestern Indian Ocean. 9(19):11215–11226.
22) Gaither MR, Bernal MA, Coleman RR, Bowen BW, Jones SA, Simison WB, Rocha LA. 2015. Genomic signatures of geographic isolation and natural selection in coral reef fishes. Molecular Ecology. 24(7):1543–1557.
23) Downie AT, Lefevre S, Illing B, Harris J, Jarrold MD, McCormick MI, et al. (2023) Rapid physiological and transcriptomic changes associated with oxygen delivery in larval anemonefish suggest a role in adaptation to life on hypoxic coral reefs. PLoS Biol 21(5): e3002102.
24) Nilsson GE, Hobbs JPA, O¨stlund-Nilsson S. Tribute to P. L. Lutz. 2007. Respiratory ecophysiology of coral-reef teleosts. J Exp Biol. 210:1673–1686.
25) Rabosky DL, Chang J, Title PO, Cowman PF, Sallan L, Friedman M, Kaschner K, Garilao C, Near TJ, Coll M, et al. 2018. An inverse latitudinal gradient in speciation rate for marine fishes. Nature. 559(7714):392–395
26) Kleyton Magno Cantalice, Jesús Alvarado-Ortega, Bellwood DR, Siqueira AC. 2022. Rising from the Ashes: The Biogeographic Origins of Modern Coral Reef Fishes. 72(8):769–777.
27) Hobgood NN. 2006 Nov 11. English: Amphiprion melanopus (Red and black anemonefish) in a field of Entacmaea quadricolor (Bubble sea anemones). Wikimedia Commons.