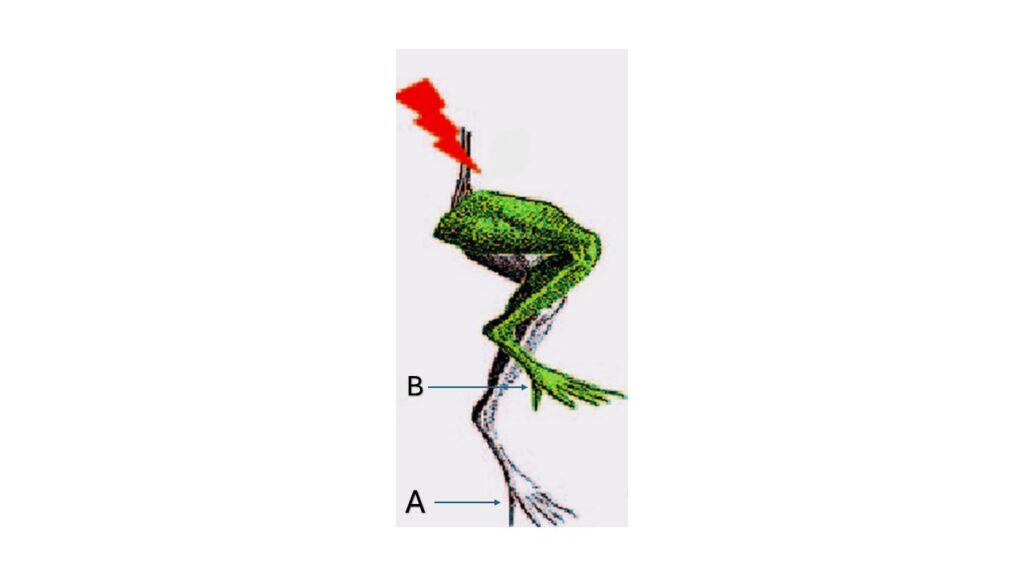
في منتصف القرن السادس عشر، وفي إحدى الليالي الشتوية لمدينة بولونيا الإيطالية، يصل ضيف متوقع لكنه ثقيل غير مرحب به من أهل المدينة، إنها عاصفة رعدية عاتية تضرب المدينة، ولا تلقى من أهلها سوى الكلل والكر والفر، ولكن من أهل المدينة أجمعين وقف شخص واحد وزملاؤه مرحبين بهبوب العاصفة، كان هذا الشخص هو «لويجي جالفاني» (Luigi Galvani).
كان جالفاني وزملاؤه في شرفة المعمل ممسكين بقضيب معدني يربط موصل (سلك كهربي) بينه وبين العصب الوركي لضفدع ميت، منتظرين أن تضرب صاعقة كهربية من العاصفة القضيب المعدني ليروا تأثير الكهرباء الموجودة في الغلاف الجوي على أجسام الكائنات الحية وطريقة تفاعلها معها.
وعندما ضربت صاعقة خفيفة القضيب المعدني، لاحظ جالفاني وزملاؤه حدوث انقباضات لعضلات الفخذ للضفدع الميت. ومع تكرار التجربة، ولكن باستخدام «جرَّات ليدين» (Leyden jars) التي كانت بمثابة بطاريات بدائية في ذلك الوقت، تم ملاحظة وتسجيل نفس النتائج.
أوضحت التجربتان السابقتان كيف يستجيب جسم الكائن الحي في حالة تعرضه لمصدر كهرباء خارجي، ولكن تأتي ملاحظة جالفاني المهمة عندما كان يُجري تشريحًا لجسد ضفدع، حيث لاحظ أنه عند ملامسة العصب الوركي الخارج من أحد ساقيه للساق المقابِلة، يحدث بتلك الساق انقباض مماثل للانقباض الذي لوحظ من قبل عند تطبيقه لمصدر خارجي للتيار الكهربي؛ مما دفع جالفاني إلى اعتقاده أن أجسام الكائنات الحية تتولد بها تيارات كهربية ذاتية، سُمِّيت وقتها بـ«الكهرباء الحيوانية» (Animal Electricity). لم يكن تفسير جالفاني في تلك الحالة صحيحًا بالضرورة، ولكن بالتأكيد كان عمله محوريًا لفهم كيفية عمل الجهاز العصبي والعضلات، كما كان حجر الأساس لعلم «الكهرباء الحيوية» (Bioelectricity)، وهو ما سنتناوله اليوم.
«الكهرباء الحيوية» (Bioelectricity): ما هي؟ وأين نجدها؟
تُعرَف الكهرباء الحيوية بأنها تيارات كهربية ذاتية المنشأ، قد تتكون بين الخلايا وبعضها، في داخلها، أو خارجها. كما أنها تكون مميزة ومتخصصة وفقًا للحدث الذي تنشأ خلاله.
قد يعتقد البعض أن الأنشطة الكهربية في أجسام الكائنات الحية تقتصر فقط على اتصال الخلايا العصبية بعضها ببعض أو على الاتصال العصبي العضلي؛ وذلك لأن الأنشطة الكهربية تحدث فقط -حسب السائد- في «الخلايا القابلة للاستثارة» (Excitable cells)، والتي تنحصر غالبًا في الأعصاب والعضلات وبعض الأنواع من الغدد.
ولكن في حالة التيارات الكهربية الحيوية، فالوضع مختلف؛ فليست وظيفتها استثارة الخلايا للوصول إلى الانقباض مثلًا كما في العضلات، أو إلى حالة «جهد الفعل» (Action potential) كما في الخلايا العصبية لنقل الرسائل والسيالات العصبية، إنما تعمل تلك التيارات الكهربية كسبيل للتواصل الخلوي لتنظيم عمليات معقدة تساهم في نمو وتطور الكائن الحي أثناء المراحل الجنينية، أو تساهم في تنظيم «عمليات التجدد» (Regeneration) و«التئام الجروح» (Wound healing) في حال اكتمال نمو الكائن الحي.
ومن أمثلة العمليات التي تساهم التيارات الكهربية الحيوية في تنظيمها: «التمايز الخلوي» (Differentiation)، «التكاثر الخلوي» (Proliferation)، «التشكل» (Morphogenesis)، و«تكوين الأعضاء» (Organogenesis). وبما أن وظيفة تلك التيارات لا تكمن في الاستثارة الخلوية، نجد أنها تحدث في أنواع من الخلايا قد تكون «غير قابلة للاستثارة» (Non-Excitable cells)، مثل: «الخلايا الظهارية» (Epithelial cells)، «الخلايا الجذعية الجنينية» (Embryonic stem cells)، و«الخلايا الجذعية المتوسطة» (Mesenchymal stem cells).
يبقى سؤال لم تتم الإجابة عنه، وهو…
كيف تنشأ التيارات الكهربية الحيوية بين الخلايا وبعضها أو خارجها؟
في الواقع، تتطلب الإجابة عن ذلك السؤال استرجاع بعض من معلوماتنا الأساسية عن الفيزياء الكهربية، وعن «قانون أوم» (Ohm’s law) للدائرة المغلقة. والآن، لنتخيل أن لدينا واحدة من أبسط الدوائر الكهربية، حيث تتكون من: بطارية، مقاومة، وموصل كهربائي. ثم يتم توصيل الدائرة كما هو موضح بالشكل رقم (2).
في حال أن الدائرة الكهربية مغلقة كما هو موضح، سيحدث اندفاع لفيض من الإلكترونات (جسيمات سالبة الشحنة) من الطرف السالب للبطارية عبر الموصل وصولًا للطرف الموجب للبطارية، ما يؤدي لتوليد تيار كهربي يكون اتجاهه معاكسًا لاتجاه حركة الإلكترونات في الموصل.
تعتمد قوة سريان الإلكترونات في الموصل على فرق الجهد الكهربي بين نقطتين، وبما أن للبطارية طرفين أحدهما سالب الشحنة تتركز فيه الإلكترونات والآخر شحنته موجبة ونسبة الجسيمات السالبة فيه أقل بكثير من الطرف السالب، فإن الإلكترونات تسير من الطرف السالب إلى الموجب خلال الموصل. وكلما زاد فرق الجهد بين الطرفين أو القطبين بزيادة الفرق في الطاقة بينهما، يزداد معدل السريان والاندفاع للإلكترونات. وعليه، تزداد شدة التيار الكهربي المار في الموصل.
نستنتج مما سبق أن التيار الكهربي يتولد نتيجة لحركة الجسيمات المشحونة (الإلكترونات في الحالة المذكورة أعلاه) في الموصل، وتعتمد شدته وفقًا لقانون أوم للدائرة المغلقة على زيادة فرق الجهد وتقليل المقاومة (I=V/R).
من المعلومات السابقة التي استرجعناها عن قانون أوم للدائرة الكهربية، يمكننا فهم كيفية نشأة التيارات الكهربية الحيوية. بالطبع لا يوجد داخل خلايا الكائن الحي إلكترونات سالبة أو غيرها من البروتونات الموجبة أو النيوترونات المتعادلة الحرة، ولكن عوضًا عن كل ذلك توجد كاتيونات موجبة الشحنة الكهربية، مثل: الصوديوم، البوتاسيوم، الكالسيوم، والماغنيسيوم. وهناك أنيونات سالبة الشحنة الكهربية أيضًا، مثل الكلورين. وبما أن هناك تواجدًا لجسيمات مشحونة، يمكن أن ينشأ فرق جهد بين تلك الجسيمات نتيجة لاختلاف توزيعها في الخلايا، مما يعمل على توليد حركة لتلك الجسيمات المشحونة من خلال «الفتحات الموجودة بالتقاطعات بين الخلايا» (Gap junctions)، أو عبر «قنوات ومضخات الأيونات» (Ion channels & pumps) التي تعمل كل منها على تأدية دور الموصل -كما في الدائرة الكهربية في الشكل رقم (1) المذكور أعلاه- حيث تتحرك خلالهم الجسيمات المشحونة. ونتيجة لحركة الجسيمات المشحونة، ينشأ تيار كهربي مميز وخاص بالحدث الذي يحدث خلاله.
أهمية دراسة الأنماط الكهربية الحيوية أثناء النمو والتطور الجنيني
تظهر التيارات الكهربية الحيوية أثناء تطور ونمو الكائن الحي في المراحل الجنينية الأولى على شكل «أنماط حصرية» (Exclusive bioelectrical patterns) مرتبطة بـ«الحدث الإنمائي» (Developmental event). فعلى سبيل المثال: معروفٌ من دراسات عدة أن بداية تكوين الأطراف الأمامية لأجنة الفئران النامية تبدأ من «اليوم الجنيني العاشر» (Embryonic day No. 10)، وينمو ويتمايز الطرف على مدار الرحلة الإنمائية.
لكن العلماء لاحظوا -خلال «اليوم الجنيني الثاني عشر» (Embryonic day No. 12)- ظهور نمط كهربي حيوي مميز يحدث في كل مرة قبل تمايز «الخلايا الجذعية الوسيطة» (Mesenchymal stem cells) إلى «الغضاريف» (Chondrocytes)، تمهيدًا لتكوين العظام فيما بعد في «الطرف النامي» (Developing limb). ولدراسة أهمية ذلك النمط الكهربي، بدأ العلماء بالتلاعب في النمط الكهربي وتغييره، ما أدى إلى إعاقة عملية النمو بالكامل، تاركةً العديد من التشوهات الشديدة في الطرف النامي، وهو ما يؤكد على دور الأنماط الكهربية الحيوية أثناء عمليات الإنماء.
في تجربة أخرى مثيرة للاهتمام أُجريت على أجنة «الضفدع الإفريقي ذي المخالب» (Xenopus Laevis)، درس العلماء الأنماط الكهربية الحيوية التي تتولد أثناء تكوين العين في الأجنة النامية، وقاموا بعد ذلك بتطبيق تلك الأنماط الكهربية على منطقة في الأجنة مُقدَّر لها في المستقبل بعد وقت من النمو والتطور أن تكون «الجزء الذيلي» (Caudal region) في يرقات الضفادع.
لاحظ العلماء -أثناء تطور الأجنة وصولًا إلى مرحلة اليرقات- نمو «عين ذات قدرات وظيفية كاملة» (Functional eye) في المنطقة الذيلية، وليست مجرد «عين مُلحَقة» (Accessory eye). وعلى الرغم من نموها في «مكان غير طبيعي» (Ectopic eye)، وفرت الأنماط الكهربية الحيوية معلومات كاملة للخلايا في تلك المنطقة من الأجنة، بل وأقنعتها بإنماء عين وظيفية كاملة تكيف معها باقي الجسم، مما يجعلنا نفكر في مدى قدرة الأنماط الكهربية الحيوية علي التحكم بـ«الشبكة الجينية» (Genetic Network)، وقدرتها على تنظيم العمليات المعقدة التي ذكرناها من قبل، وهي: التمايز، التكاثر، الهجرة الخلوية، وعمليات التشكل وتكوين الأعضاء.
يسعى العلماء مؤخرًا إلى فك شفرات ودراسة الأنماط الكهربية الحيوية، خاصةً تلك التي تحدث خلال النمو والتطور الجنيني، حيث إنها تمثل أداة جديدة واعدة أكثر سهولة وشمولًا لفهم ودراسة العمليات المعقدة والتحكم بها. وقد تتاح الفرصة مستقبلًا أن نتحدث بقليل من التعمق عن الأنماط الكهربية الحيوية التي تظهر في الخلايا قبل الإصابة بالسرطانات، وكيف يمكن أن تكون «الأدوية المضادة للاختلاج» (Anticonvulsant drugs) علاجًا فعالًا في تلك الحالات، كما يمكن أن نناقش الوعد الذي تعدنا به دراسة تلك الأنماط بخصوص التجديد الكامل للأعضاء المعقدة في الفقاريات العليا.
المصادر:
Piccolino M. Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology. Trends Neurosci. 1997 Oct;20(10):443-8. doi: 10.1016/s0166-2236(97)01101-6. Erratum in: Trends Neurosci 1997 Dec;20(12):577. PMID: 9347609.
McCaig CD, Rajnicek AM, Song B, Zhao M. Controlling cell behavior electrically: current views and future potential. Physiol Rev. 2005 Jul;85(3):943-78. doi: 10.1152/physrev.00020.2004. PMID: 15987799.
Christensen, D.A. (2009). Ohm’s Law: Current, Voltage and Resistance. In: Introduction to Biomedical Engineering: Biomechanics and Bioelectricity Part II. Synthesis Lectures on Biomedical Engineering. Springer, Cham. https://doi.org/10.1007/978-3-031-01638-7_1.
Atsuta Y, Tomizawa RR, Levin M, Tabin CJ. L-type voltage-gated Ca2+ channel CaV1.2 regulates chondrogenesis during limb development. Proc Natl Acad Sci U S A. 2019 Oct 22;116(43):21592-21601. doi: 10.1073/pnas.1908981116. Epub 2019 Oct 7. PMID: 31591237; PMCID: PMC6815189.
Blackiston DJ, Levin M. Ectopic eyes outside the head in Xenopus tadpoles provide sensory data for light-mediated learning. J Exp Biol. 2013 Mar 15;216(Pt 6):1031-40. doi: 10.1242/jeb.074963. PMID: 23447666; PMCID: PMC3587383.
Pai VP, Aw S, Shomrat T, Lemire JM, Levin M. Transmembrane voltage potential controls embryonic eye patterning in Xenopus laevis. Development. 2012 Jan;139(2):313-23. doi: 10.1242/dev.073759. Epub 2011 Dec 7. Erratum in: Development. 2012 Feb 1;139(3):623. PMID: 22159581; PMCID: PMC3243095.
McLaughlin KA, Levin M. Bioelectric signaling in regeneration: Mechanisms of ionic controls of growth and form. Dev Biol. 2018 Jan 15;433(2):177-189. doi: 10.1016/j.ydbio.2017.08.032. Epub 2017 Dec 25. PMID: 29291972; PMCID: PMC5753428.