بروتينات «تاو» ومرض «ألزايمر»: مرضيات التاو والعلاج المناعي أمل جديد يطرحه العلماء
الكاتب: بيشوي عماد مليك عزيز
مرض ألزايمر يبعث بالأسوأ
أليس مما يبعث على الضيق أن يفقد الأقربون -رغمًا عنهم- المكوّن البشري الأعلى قيمةً وحيويةً «الذاكرة»؟
الذاكرة هي ما تميزنا عن أقراننا من حولنا، وهي القدرة المعقدة وراء تذكر العديد من التفاصيل التي نحتاج إليها في أنشطتنا اليومية المعتادة، فهي قاعدة البيانات البيولوجية التي تخزن إنجازاتنا وأسماء أصدقائنا وأرقام هواتفنا والأماكن التي نضع فيها حاجياتنا اليومية وغيرها الكثير، فلا يمكنك تصوّر الصعوبات التي يواجهها مريض بذاكرة تضعف وفي طريقها إلى الانهيار!
مرض «ألزايمر» (Alzheimer’s Disease) هو المرض المتسبب في ذلك ويحمل اسم مكتشفه «ألويس ألزايمر». ويعد ذلك المرض واحدًا من مسببات اختلال الإدراك الذي يؤدي إلى النسيان.
عادةً ما يكون مرض ألزايمر نتيجة طفرة في جينات معينة مثل جينات «بروتينات الأميلويد» (Amyloid Precursor) المحمولة على كروموسوم 21، أو «بريسلين 1»(Presilin 1) المحمول على كروموسوم ١٤، أو «بريسلين 2» المحمول على كروموسوم 1. هذه الطفرات في الحمض النووي منقوص الأكسجين(DNA) تؤدي بالتبعية عن طريق عملية «الترجمة» (Translation) إلى تكوين بروتينات غير فعّالة تترسّب بشكل مرضي في قشرة المخ خارج الخلايا العصبية فيما يسمى ببروتينات الأميلويد، أو تترسب متجمعة داخل الأعصاب فيما يسمى بـ «التشابكات الليفية العصبية» (Neurofibrillary Tangles) والتي تتكون من وحدات أصغر تسمى «بروتينات التاو» (Tau Proteins). إذا كنت تعمل في مجالات الأبحاث الطبية على الأمراض العصبية، فربما تعاملت قبلًا مع بروتينات الأميلويد، بينما قد تبدو بروتينات التاو غير مألوفة، إلا أن الأخيرة محل الاهتمام البحثي في وقتنا هذا نظرًا لقيمتها العلاجية المثبتة بالتجارب السريرية.
بروتينات التاو: حقائق فسيولوجية ومرضية
تاو هي بروتينات مرتبطة بـ «الأنيبيبات الدقيقة»(Microtubule Associated) وهي إحدى مكونات هيكل الخلية. توجد بشكل رئيسي في الخلايا العصبية، ويمكن أن تتواجد بنسب قليلة في خلايا الجسم الأخرى. هذه البروتينات التي اكتشفت عام ١٩٧٥ م تلعب دورًا محوريًا في استقرار ووظيفة أنيبيبات الخلايا العصبية، وتشترك في العديد من الآليات الحيوية للخلية العصبية مثل «الإشارات الخليوية» (Cell Signaling) و«مرونة التشابكات العصبية» (Synaptic Plasticity)، وهي المسؤولة عن الذاكرة وتخزين المعلومات وتنظيم الاستقرار الجيني والهيئة الكلية لبنية الخلية.
بروتينات التاو تمر بالعديد من «تعديلات ما بعد الترجمة» (Post-translational Modifications) كالفسفرة أو إضافة جزيئات الجلوكوز أو الأسترة أو إضافة الأسيتيل أو غيرها، فهناك 80 مكانًا على جزيء التاو الواحد! وكبروتين يتكون التاو من سلسلة من عديد الببتيد، وهي تسلسل من الأحماض الأمينية المرتبة والمرتبطة معًا بروابط ببتيدية، مما يسمح بإضافة الفوسفور إليه عن طريق الفسفرة، وحال حدوث فسفرة زائدة عن الحد (Hyperphosphorylation) لجزيئات التاو المرتبطة بالأنيبيبات، تحدث زيادة في نشاط إنزيم «الجليكوجين سينثيز كينيز» (Glycogen Synthase Kinase 3-beta) مع عوامل أخرى تفقدها قدرتها على التمسك بتلك الأنيبيبات، فتنفصل عنها نتيجة لتغير البنية التركيبية الفسيولوجية العادية للتاو.
تمتلك جزيئات التاو الحرة المنفصلة قدرة أعلى على الالتصاق ببعضها، وبدورها تتحد معًا مترسبة في صورة التشابكات التليفية العصبية، وتؤدي هذه الترسبات البروتينية لجزيئات التاو إلى نتائج سلبية عديدة في الوظائف الحيوية للخلية العصبية، منها:
– ضعف المحور العصبي (Axonal Impairment).
– تغيُّر تركيب وبنية التشابك العصبي
– ضعف وظائف الميتوكوندريا
– تحلل البروتينات داخل الخلية العصبية بشكل غير فعال
وتُشكّل هذه النتائج مجتمعةً «خلل التاو المرضي» (Tauopathies). في مرض ألزايمر، تترسب التشابكات التليفية العصبية بشكل أساسي في المنطقة بين جسم الخلية العصبية ومحورها (Perikaryon)، ومن ثم لا تلبث أن تنتشر بآلية أشبه بـ «البريونات» (Prion-like Distribution) (والبريونات هي تراكيب مسببة للأمراض تتكون من تجمعات بروتينية بلا حمض نووي) لتنتقل من خلية عصبية إلى أخرى، ويمكنها الوصول إلى نطاقات بعيدة في المخ مثل «الهيبوكامبس» (Hippocampus).
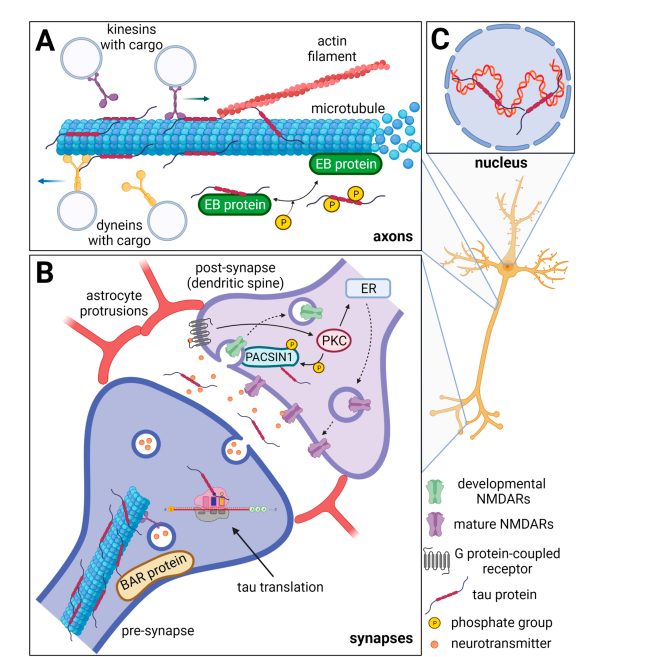
صورة. 1: صورة توضيحية للآلية الفسيولوجية للخلية العصبية [6]
العلاج المناعي: أمل جديد لضعف الذاكرة
ومع ذلك يتجدد الأمل، حيث يجري العلماء حاليًا الكثير من التجارب البحثية لإيجاد أفضل علاج لمرض ألزايمر، وقد توصلوا إلى استنتاج مثير للاهتمام هو أن العلاج المناعي الذي يستهدف بروتين الأميلويد بيتا سالف الذكر لا ينتج تحسنًا يذكر في الاستيعاب والذاكرة في البشر، على نقيض استهداف بروتينات التاو التي أظهرت نتائج مبشرة في الأبحاث التجريبية الأولية. يرجع ذلك إلى أن التحليل الهيستولوجي والدراسات القائمة على التاو المشع للبوزيترون (وهي طرق لقياس تركيز بروتينات التاو)، وجدت رابطةً وثيقةً بين بروتينات التاو وضعف الذاكرة بنسب مرتفعة عن بروتين الأميلويد. إلا أن استهداف بروتينات التاو ليس سهلًا نظرًا لتعديلات ما بعد الترجمة التي ذكرناها هنا، والتي يمكنها أن تُغيّر من قدرة اتحاد الأجسام المضادة المستخدمة في العلاج المناعي مع أماكنها الخاصة بها على جزيئات بروتين التاو. أضف إلى ذلك أن قدرة الأجسام المضادة في الارتباط تعتمد بصفة أساسية على الصيغة البنائية في الأبعاد الفراغية لجزيئات التاو (أحادية أو ثنائية أو عديدة الوحدات أو ليفية أو تشابكات تليفية عصبية).
يوقف العلاج المناعي بالأجسام المضادة السُمّيّة الناتجة عن التاو من خلال ما يلي:
- منع التجمعات الممرضة أو الجزيئات في صورة تشابكات
- منع حدوث عمليات ما بعد الترجمة
- منع عملية انتقال جزيئات التاو من خلية عصبية لأخرى
تستخدم كذلك تقنيات المناعة الذاتية (أي القدرة المناعية للجسم نفسه على مقاومة الأجسام الغريبة والميكروبات) بإعطاء جرعات من لقاح يحتوي على تحورات مرضية (غير فعّالة ولا تسبب أي ضرر نسبيًا) من جزيئات التاو عالية الفسفرة، التي تمنع خلايا العائل من مهاجمة بروتينات التاو العادية الفعّالة (التي تتولى دورًا هامًا في النقل العصبي كما أوضحنا سابقًا). إلا أن هناك تقريرًا حول إمكانية حدوث التهاب بالمخ (Encephalitis) كعرض جانبي.
قد تبدو تقنيات المناعة المكتسبة أكثر جاذبية من تقنيات المناعة الذاتية، إلا أنها قد تتسبب عن طريق الخطأ في مهاجمة البروتينات الفعّالة. وبالنسبة للتقنيتين، فلا مشكلة فيما يتعلق بكيفية تخطي الحاجز الدموي المخي الذي يكون ضعيفًا بالفعل لدى مرضى ألزايمر. كما أن بعض الأوراق العلمية رجحت استخدام التقنيتين معًا لأنهما قدمتا نتائج أفضل.
نتائج كلتي التقنيتين مبشرة وواعدة بدرجة كبيرة وفقًا لآراء الخبراء والأوراق العلمية، وقد وافقت نتائج الأبحاث الأولية معايير الأمن والسلامة الصحية العالمية واجتازت بنجاح المرحلة الأولى للتجارب السريرية وفي طريقها للمرحلة الثانية. فهل نحن على بعد خطوات قليلة من اكتشاف طريقة ثورية لعلاج مرض ألزايمر؟ هل ستكلل محاولات البشر بالنجاح في معركتهم للإبقاء على ذاكرة صحيحة وسليمة لفترة أطول نسبيًا؟ نأمل أن تعود هذه التجارب بالنفع على البشر.
المراجع:
Oxford handbook of medical neurolog
Congdon EE, Sigurdsson EM. Tau-targeting therapies for Alzheimer disease. Nat Rev Neurol. 2018 Jul;14(7):399-415. doi: 10.1038/s41582-018-0013-z. PMID: 29895964; PMCID: PMC6463489
Šimić G, Babić Leko M, Wray S, Harrington C, Delalle I, Jovanov-Milošević N, Bažadona D, Buée L, de Silva R, Di Giovanni G, Wischik C, Hof PR. Tau Protein Hyperphosphorylation and Aggregation in Alzheimer’s Disease and Other Tauopathies, and Possible Neuroprotective Strategies. Biomolecules. 2016 Jan 6;6(1):6. doi: 10.3390/biom6010006. PMID: 26751493; PMCID: PMC4808800
Bakota L, Brandt R. Tau Biology and Tau-Directed Therapies for Alzheimer’s Disease. Drugs. 2016 Mar;76(3):301-13. doi: 10.1007/s40265-015-0529-0. PMID: 26729186; PMCID: PMC4757605
Wang C, Holtzman DM. Bidirectional relationship between sleep and Alzheimer’s disease: role of amyloid, tau, and other factors. Neuropsychopharmacology. 2020 Jan;45(1):104-120. doi: 10.1038/s41386-019-0478-5. Epub 2019 Aug 13. PMID: 31408876; PMCID: PMC6879647
Sinsky J, Pichlerova K, Hanes J. Tau Protein Interaction Partners and Their Roles in Alzheimer’s Disease and Other Tauopathies. Int J Mol Sci. 2021 Aug 26;22(17):9207. doi: 10.3390/ijms22179207. PMID: 34502116; PMCID: PMC8431036