العلاج المناعي للسرطان: لماذا لا يهاجم الجهاز المناعي الخلايا السرطانية؟
بقلم : فارس رجب عبدالعليم
استغل الأطباء الأوائل قدرة الجهاز المناعي على مقاومة السرطان قبل أن يعرفوا الكثير عن آلياته ومكوناته، حيث سُجِّلت حالات شفاء كامل لمرضى مصابين بالسرطان بعد إصابتهم بإصابة بكتيرية أو فيروسية. لم يفهم المعالجون سبب هذه الظاهرة، إلا أنهم طوروا عقاقير مضادة للسرطان تعتمد على إصابة المرضى بالبكتريا والفيروسات.
أطلق على أول هذه العقاقير (Coley’s Toxin) نسبة للعالم «ويليام كولي» (William Coley) الذي طوره عام 1891 من بكتريا نشطة وأخرى مقتولة حراريًا، ونتج عن استخدامه تراجع سرطان العظام (Sarcoma) عند أكثر من 1000 مريض. ونتيجةً لإسهامه، لُقِّب «وليام كولي» بـ “أبي العلاج المناعي” (1). كما سُجِّلت عام 1904م حالات تراجع لسرطان الدم عند المرضى بعد إصابتهم بفيروس الإنفلونزا (1). رغم ذلك، توقف التقدم في تطوير العلاجات المناعية بعدها نتيجة لتطور العلاج الكيماوي والإشعاعي. ولكن ماذا كان المبدأ العلمي لـ «عقار كولي»؟ وما علاقته بالجهاز المناعي؟
يكمن الأثر العلاجي لـ «عقار كولي» في أنه يحفز الجهاز المناعي لينتج استجابة مضادة للبكتريا والسرطان على حد سواء، حيث تعرض الخلايا السرطانية على سطحها جزيئات غريبة عن الجسم -تُسمَّى «المستضدات» (Antigens)- تحفز جهاز المناعة على التعرف عليها ومهاجمتها. ونستعرض في هذا المقال الأسباب الرئيسية وراء عدم الاستجابة للعلاجات المناعية في كثير من الأحيان، كما نستعرض محاولات العلماء لدراستها والتغلب عليها.
التنظيم المناعي السلبي والبيئة الدقيقة المحيطة بالورم
عام 2018، حصل العالمان «جيمس أليسون» (James P. Allison) و«تاسوكو هونجو» (Tasuku Honjo) على جائزة نوبل في الطب لاكتشافهما علاجًا للسرطان عن طريق تثبيط التنظيم المناعي السلبي. ولفهم هذا، علينا المرور على آلية عمل الجهاز المناعي (2).
للجهاز المناعي في الإنسان ذراعان:
- «المناعة الفطرية» (Innate Immunity)، وهي آلية مناعية غير متخصصة، لذا تستجيب ضد جميع الأجسام الغريبة والممرِضة بنفس الطريقة. ومن مكوناتها: «الخلايا القاتلة الطبيعية» (Natural Killer Cells, NK)، و«الخلايا العارضة للأنتيجينات» (Antigen Presenting Cells, APCs).[1]
- المناعة المكتسبة» (Adaptive Immunity)، وتستجيب بتخصُّصيةٍ ضد كل جسم غريب عن طريق إفراز أجسام مضادة لتدميره قبل دخوله الخلايا، أو تحفيز «الخلايا التائية القاتلة» (Killer T cells) لقتل الخلايا المصابة بالكائن الممرض أو الخلايا السرطانية (3)، (4).
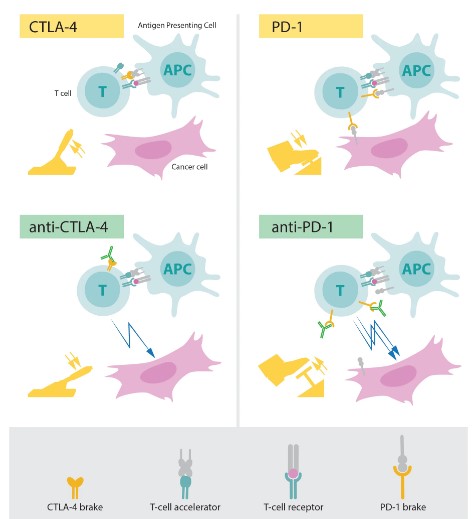
قد يؤدي النشاط المفرط للخلايا التائية إلى قتلها الخلايا الصحية (كما يحدث في أمراض المناعة الذاتية)، لذا يُنظَّم نشاط الخلايا التائية عن طريق «نقاط الفحص المناعية» (Immune Checkpoints) المحمولة على سطحها، مثل: «مستقبِل الموت المبرمَج» (PD1)، و«مستقبِل الأنتيجين الرابع للخلايا التائية القاتلة» (CTLA-4). ويكون هذا التنظيم إما بالإيجاب لتحفيز الاستجابة المناعية ضد الخلايا المصابة بالعدوى أو الخلايا السرطانية، أو بالسلب لكبح نشاط الخلايا المناعية بعد التعافي من العدوى أو السرطان (4)، (5).
تستغل الخلايا السرطانية خاصية التنظيم المناعي السلبي لتثبيط «الاستجابة المناعية المضادة للورم» (Antitumor Immunity) عن طريق «الاستعراض المفرط» (Overexpression) لنقاط الفحص المناعية على سطحها (وتسمى PDL1)، والتي ترتبط بشكل متخصص بنقاط الفحص الموجودة على الخلايا التائية (PD1) فتُوقِف عملها. كما توجَد نقاط فحص (PDL2) على الخلايا المناعية العارضة للأنتيجينات (APCs)، والتي ترتبط أيضًا بمستقبِل (PD1) على الخلايا التائية فتُثبِّطها. وكذلك يعمل مستقبِل (CTLA-4) على تثبيط تكاثر الخلايا التائية، مما يحد من انتشارها في البيئة المحيطة بالورم (6).
ينشأ عن التنظيم المناعي السلبي «بيئة دقيقة للورم» (Tumor Microenvironment, TME) تتميز بالاستعراض المفرط لنقاط الفحص المناعية، وانتشار الخلايا المناعية المثبطة كالخلايا العارضة للأنتيجينات، وقلة «الخلايا التائية الفعالة» (Effector T cells)، مما يؤدي إلى تثبيط الاستجابة المناعية المضادة للسرطان (6)، (7).
العلاج المناعي بمثبطات نقاط الفحص
قام العالمان «أليسون» و«هونجو» باكتشاف نقاط الفحص المناعية (CTLA-4) و(PD1)، وترتَّب على هذا تطوير أجسام مضادة لهذه المستقبِلات، وهي -على التوالي- (Anti PD1/PDL1) و(Anti CTLA-4) وتُعرَف بـ «مثبطات نقاط الفحص» (Immune Checkpoint Inhibitors, ICI). ترتبط هذه الجزيئات بنقاط الفحص (PD1) و(CTLA-4) على سطح الخلايا التائية فتمنع ارتباطها بنقاط الفحص المثبطة على الخلايا السرطانية والخلايا العارضة للأنتيجينات، وتُعزِّز الاستجابة المناعية المضادة للسرطان (2) (7). (انظر صورة 1)
في سابقة وإنجاز علمي في مجال العلاج المناعي، وافقت «هيئة الغذاء والدواء» (FDA) عام 2011 على إنتاج واستخدام عقار (Ipilimumab)، وهو جسم مضاد لمستقبِل (CTLA-4). ووافقت عام 2016 على عقار (Pembrolizumab)، وهو جسم مضاد لمستقبِل (PD1) لعلاج سرطان الجلد (Melanoma)، وكذلك عقار (Atezolizumab) كمضاد لمستقبِل (PDL1) لعلاج سرطان المثانة (8).
رغم ذلك، تقِلُّ الاستجابة للعلاج نتيجةً لقلة «الخلايا التائية الوافدة للورم» (Tumor-infiltrating T cells) وقلة «المحتوى الطفرى للورم» (Tumor Mutational Burden)، حيث إن زيادة التحورات الجينية في الخلايا السرطانية -وبالتبعية زيادة استعراضها للبروتينات المتحورة- تجعلها أكثر عرضة للهجوم المناعي (7).
Note. From Nobel Prize®, 2022,
Nobelprize.org (https://www.nobelprize.org/prizes/medicine/2018/press-release).
In the Public Domain
طرق أخرى للعلاج المناعي
العلاج بـ «الخلايا التائية المتبناة» (Adoptive T cell Therapy)
ويعتمد على عزل الخلايا التائية الفعالة من الورم مباشرة، ثم زراعتها وإكثارها معمليًا وإمداد المريض بها. ويتضمن تعديل المحتوى الوراثي للخلايا التائية بحيث تستعرض على سطحها مستقبِلات متخصصة مضادة لنظيراتها على الخلايا السرطانية، مثل: (CARs T cell) (9). وافقت (FDA) عام 2017 على «الخلايا التائية الموجهة» (CAR T cell) ضد مستقبِل (CD19) لعلاج «سرطان الخلايا البائية» (B Cell Lymphomas). رغم ذلك، يواجه العلاج بالخلايا التائية تحديات في حالة الأورام قليلة المحتوى الطفري، والتي تُسمَّى بـ «الأورام الخامدة» (Cold Tumors) (8).
العلاج بـ «الفيروسات المحلِّلة للأورام» (Oncolytic Viruses)
تختص هذه الفيروسات بالقدرة على إصابة الخلايا السرطانية مؤديةً إلى تحللها (Oncolysis)، وذلك لانتشار المستقبِلات الخاصة بها على أسطح الخلايا السرطانية. كما أنه نظرًا لكثرة التحورات الوراثية بالخلايا السرطانية، يحدث خلل في توليد «المسار المضاد للفيروسات» (Antiviral Pathway). ويتضمن العلاج فيروسات طبيعية أو محوَّرة وراثيًا؛ بحيث تفقد الجينات المسببة للمرض تجاه الخلايا السليمة وتعبر عن مستقبِلات متخصصة مضادة للورم، ويمكن استخدامها بالتوازي كـ «ناقلات جينية» (Genetic Vectors) للتعبير عن جزيئات محفَّزة للاستجابة المناعية مثل «السيتوكينات» (Cytokinins) (10).
اعتُقِد منذ بدايات القرن العشرين في دور العلاج بالفيروسات في توليد استجابة مناعية مضادة للسرطان والتغلب على الأثر التثبيطي للبيئة الدقيقة للورم؛ حيث أدى تحلل الخلايا السرطانية إلى انطلاق «البروتينات السرطانية المتحورة» (Tumor Associated Antigens) خارج الخلايا، فسَهُلَ تعرُّف الخلايا المناعية عليها ونتجت استجابة مناعية مضادة للورم، فزاد توافُد الخلايا التائية القاتلة إلى البيئة السرطانية (1) (10).
في عام 2015، وافقت (FDA) على عقار (T-VEC)، وهو «فيروس الهربس البسيط» المعدَّل وراثيًا (HSV1) لعلاج سرطان الجلد. تلا ذلك إجراء نظام «العلاج المركَّب» (Combinational Therapy) القائم على استغلال قدرة الفيروسات المحللة للأورام في تنشيط الاستجابة المناعية لمؤازرة العلاج المناعي بمثبطات نقاط الفحص، أو بالخلايا التائية المتبناة (8).
المصادر
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1888599
- https://www.nobelprize.org/prizes/medicine/2018/press-release/
- https://www.frontiersin.org/articles/10.3389/fimmu.2020.00683/full
- https://pubmed.ncbi.nlm.nih.gov/28718424/
- https://pubmed.ncbi.nlm.nih.gov/25861977/
- 0https://aacrjournals.org/cancerdiscovery/article/8/9/1069/10253/Fundamental-Mechanisms-of-Immune-Checkpoint
- https://www.nature.com/articles/nrc3239
- https://jcmtjournal.com/article/view/2275
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7022375/