إعداد: فاطمة الزهراء عبد المجيد
أعلنت اليوم (1) اللجنة الخاصة بجائزة نوبل في معهد كارولينسكا بالسويد حصول عالمة الكيمياء الحيوية المجرية «كاتالين كاريكو» (Katalin Karikó) بالاشتراك مع عالم المناعة الأمريكي «درو ويزمان» (Drew Weissman) على جائزة نوبل للطب على خلفية عملهما على تقنية تطوير اللقاحات باستخدام «الحمض النووي الريبي الرسول» (mRNA)، هذا العمل الذي أفضى في عام 2020 إلى ابتكار لقاحين ضد فيروس كورونا الذي تسبب في جائحة عالمية أدت إلى وفاة الملايين. وبفضل هذين اللقاحين، أُنقذت حيوات ملايين آخرين بنسبة استجابة للقاح تتجاوز الـ95%. لم يكن كاريكو وويزمان أول من خطر له إمكانية ابتكار لقاحات بواسطة الحمض النووي الريبي الرسول، لكن أبحاثهما التي تركزت عليه جعلت من مجهوداتهما باب أمل مفتوح أمام انتقال لقاحات الحمض النووي الرسول إلى التجارب السريرية.
كانت تقنيات صناعة اللقاحات مقتصرة حتى وقت قريب على ثلاث تقنيات تستفز الجهاز المناعي ليواجه العدوى المحتملة: الأولى عبارة عن الفيروس المستهدَف ضعيفًا أو مُثبَّطًا، والثانية باستخدام فيروس غير فاعل كوسيط ناقل للمادة الوراثية للفيروس المستهدَف، والثالثة باستخدام بروتينات معدلة ومشتقة من الفيروس المستهدَف. لكن هذه التقنيات واجهت عدة صعوبات كانت أهمها صعوبات تتعلق بـ«زراعة الخلايا» (Cell culture)، وهي مرحلة من مراحل تصنيع اللقاح، يتم فيها إنماء الفيروسات في خلايا ذات عمر افتراضي لثدييات أو طيور أو حشرات، وتتمثل الصعوبة في إمكانية إنتاج المزارع الخلوية على نطاق واسع. ومن الصعوبات الأخرى أن يكون ناتج الفيروسات المستهدَفة عن هذه المزارع ضئيلًا، إلى جانب احتمالية ألا تخلو هذه الخلايا من فيروسات أخرى عرَضية (2).
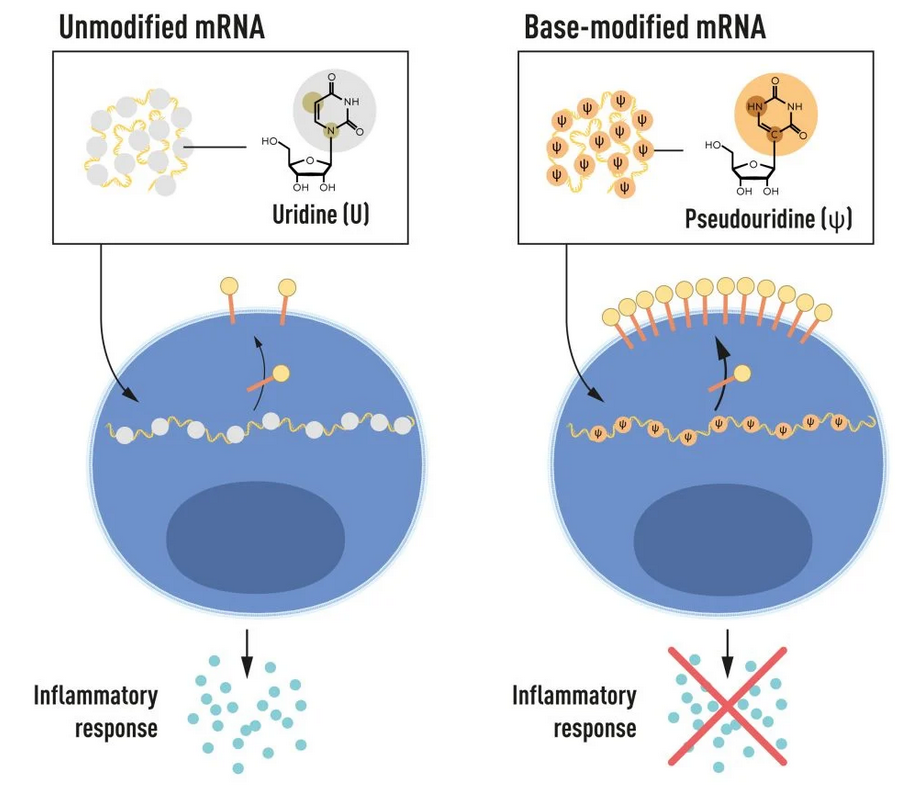
الحمض النووي الريبي الرسول هو الذي تُترجَم من خلاله الشفرة الوراثية إلى بروتينات ذات وظائف محددة في جسد الكائن الحي، والنيوكليوسيدات هي الوحدات البنائية للحمض النووي الريبي (باستثناء مجموعة الفوسفات)، وتشمل كلًا من القواعد النيتروجينية وسكر الكربون الخماسي. في ثمانينات القرن الماضي، طُوِّرت تقنية استنساخ الحمض النووي الريبي الرسول معمليًا (In vitro)، لكن جزيئات الـmRNA الناتجة عنها سببت استجابات التهابية، لذا بات انتقال هذه التقنية إلى التجارب السريرية أمرًا محدودًا. لكن كاريكو وويزمان كان لديهما إصرار مكَّنهما من تجاوز هذا التحدي، فلاحظا أن الخلايا المناعية المتغصِّنة (Dendritic Cells) تصنف جزيئات الـmRNA المستنسَخة معمليًا على أنها جسم غريب على عكس الـmRNA المستنسَخ بواسطة الزراعة الخلوية في الخلايا الثديية، مما يؤدي بدوره إلى حدوث تلك الاستجابة الالتهابية (3).
جاء الفتح العلمي بعد تلك الملاحظة؛ فوفقًا لمعرفتهما المسبقة بأن القواعد النيتروجينية المكوِّنة للحمض النووي الريبي تتعدل كيميائيًا في الخلايا الثديية التي لا تسبب الالتهاب، قام العالمان بتعديل القواعد النيتروجينية كيميائيًا للـmRNA المستنسَخ معمليًا، وكانت النتيجة عدم وجود استجابة التهابية من الخلايا المناعية المتغصِّنة. وفوق ذلك، زادت إنتاجية البروتينات فيما كانت إنتاجيتها محدودة قبل ذلك (4,5). وقد أدركا أن من شأن هذه النقلة النوعية أن تغير كليًا من فهمنا لاستجابة الخلايا للحمض النووي الريبي الرسول. لذا، نشرا ما توصَّلا إليه عام 2005 (3)، أي قبل الجائحة بـ15 عامًا. وبذلك فتح اكتشافهما بابًا جديدًا لتطوير اللقاحات، انعكست نتائجه على تطوير لقاحي فيروس زيكا و(MERS-CoV)، ثم تلاهما لقاح فيروس كورونا. وهناك لقاحات أخرى، مثل لقاح الملاريا، تدق الأبواب.
المراجع
1. The Nobel Prize in Physiology or Medicine 2023. NobelPrizeorg. [accessed 2023 Oct 2].
2. Milián E, Kamen AA. 2015. Current and Emerging Cell Culture Manufacturing Technologies for Influenza Vaccines. BioMed Research International. 2015:1–11.
3. Karikó, K., Buckstein, M., Ni, H. and Weissman, D. 2005. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175.
4. Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. 2008. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840.
5. Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. 2010. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892.