هل تشيخ أعضاؤنا بوتيرة واحدة؟
وما علاقة ذلك بالأمراض؟
في دراسة جديدة نُشِرت في مجلة «نيتشر» (Nature)(1)، أجرى الباحثون تحليلًا بروتينيًا (Proteomic Analysis) عبر تتبع مستويات من بروتينات منبثقة من أعضاء معينة ومتواجدة في بلازما الدم البشري، وذلك لقياس درجة اختلاف شيخوخة تلك الأعضاء لدى الأفراد ومدى ارتباطها بالأمراض والوفاة. وتوصلوا إلى أن “مؤشرات شيخوخة الأعضاء في بروتينات البلازما تتتبع الصحة والمرض”، كما في عنوان الدراسة.
تُعرَف الشيخوخة على أنها “تدهور في الوظائف الفسيولوجية اللازمة للبقاء والخصوبة بمرور الوقت، مما يؤدي إلى الوفاة” (2)، أي أنها تؤدي إلى تدهور بنية الأنسجة ووظيفتها على مستوى الجسم، مما يزيد بشكل كبير من خطر الإصابة بمعظم الأمراض المزمنة. وكانت الدراسات المُجراة على الحيوانات قد بيَّنت -عبر تتبع التغيرات الجزيئية- أن الأفراد يشيخون بمعدلات مختلفة، وأن الأعضاء داخل الفرد الواحد تشيخ بوتيرة مختلفة كذلك (3-6). لكن، ولسوء الحظ، قليل هو ما يُعرَف عن التغيرات الجزيئية المرتبطة بالشيخوخة لدى البشر.
وعلى الرغم من تطوير عدة وسائل لقياس التغيرات الجزيئية المرتبطة بالشيخوخة لدى البشر، يقدم معظم تلك الوسائل مؤشرًا واحدًا للشيخوخة عبر سائر الجسد، وفي ذلك إغفال للتعقيدات التي تحملها عملية الشيخوخة. بعض الوسائل الحديثة تقدم مؤشرات كيميائية سريرية تعبر عن وظائف الأعضاء، إلا أنها ضعيفة من ناحية الخصوصية العضوية. أي أنها مؤشرات لا تعبر بالتحديد عن عضو معين. أما الوسائل التي تُستخدَم لتحديد عمر الدماغ، مثل الوسائل المبنية على التصوير بالرنين المغناطيسي، فهي غير دالة على التغيرات الجزيئية التي تحدث في الدماغ وتعبر عن الشيخوخة.
وفي الدراسة التي نحن بصددها، حاول الباحثون سبر أغوار البحوث السابقة، بتقديم وسيلة سهلة وفعالة لتحديد العمر البيولوجي (الذي يختلف عن العمر الزمني) للأعضاء، مع مراعاة خصوصية كل عضو والأمراض المرتبطة به. قام الباحثون بتحليل 11 عضوًا وجهازًا ونسيجًا، وهم: الأنسجة الدهنية، الشرايين، الدماغ، القلب، الأنسجة المناعية، الأمعاء، الكلى، الكبد، الرئة، العضلات، والبنكرياس. وذلك من خلال قياس 4979 بروتينًا في إجمالي 5676 شخصًا عبر خمس مجموعات مستقلة. ورسموا خريطة لبروتينات البلازما المفترضة الخاصة بالأعضاء، والتي استخدموها لتدريب نماذج خوارزمية لتعلم الآلة على التنبؤ بمدى شيخوخة الأعضاء.
من ضمن الـ4979 بروتينًا، تم تعيين 893 (18%) بروتينًا على أنها بروتينات لـ«جينات غنية في عضو ما» (Organ-enriched Genes) إذا تم التعبير عنها أربع مرات أعلى -على الأقل- في عضو واحد مقارنة بأي عضو آخر، وأغلب هذه البروتينات التي تم تعيينها مرتبطة بالدماغ. وبناء على ذلك، وجد العلماء “فجوة عمرية” بين العمر الزمني للشخص وبين عمره البيولوجي استنادًا لكل عضو حسب البروتينات المعبرة عنه؛ فالأشخاص ذوي الأعضاء الأكبر عمرًا معرضون للإصابة بالأمراض المرتبطة بهذه الأعضاء أكثر من أقرانهم.
أظهرت النتائج أن 18.4% من الأفراد يعانون من شيخوخة شديدة في أحد أعضائهم، وأن 1.7% من الأفراد يعانون من شيخوخة شديدة في عضوين أو أكثر، كما أن تسارع شيخوخة الأعضاء يزيد من خطر الوفاة بنسبة 20-50%. وترتبط الأمراض الخاصة بالأعضاء بشيخوخة تلك الأعضاء بشكل أسرع، فمثلًا: كان لدى الأفراد المصابين بارتفاع ضغط الدم كلى أكبر سنًا بحوالي عام واحد من أقرانهم من نفس العمر، في حين أن الأفراد المصابين بالسكري لديهم كلى أكبر بحوالي 1.3 عام، والأفراد الذين يعانون من الرجفان الأذيني لديهم قلوب أكبر بـ2.8 سنة، والذين يعانون من النوبات القلبية لديهم قلوب أكبر بـ2.6 سنة. وبشكل عام، وُجِد أن بعض الأمراض، مثل الأزمة القلبية ومرض ألزهايمر، ارتبطت بتسارع الشيخوخة في جميع الأعضاء تقريبًا، بينما كان لأمراض أخرى تأثيرات على عضو معين أو مجموعة فرعية من الأعضاء.
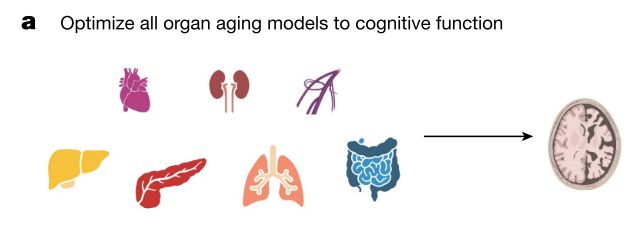
كما أشارت الدراسة إلى أن الأشخاص الذين يعانون من تسارع شيخوخة القلب، دون أن تظهر عليهم بدايةً أية أمراض نشطة أو مؤشرات حيوية غير طبيعية، كانوا أكثر عرضة بمعدل 2.5 مرة لخطر الإصابة بالسكتة القلبية، مقارنةً بالأشخاص الذين يعانون من قلوب تتقدم في السن بشكل طبيعي. وكان أولئك الذين لديهم أدمغة شائخة أكثر عرضة بمعدل 1.8 مرة لإظهار التدهور المعرفي خلال خمس سنوات، مقارنةً بأولئك الذين لديهم أدمغة أصغر بيولوجيًا. إن تسارع شيخوخة الدماغ أو الأوعية الدموية يتنبأ بخطر تطور مرض ألزهايمر، حسب ما تخبرنا به أفضل المؤشرات الحيوية السريرية المستخدمة حاليًا.
وبالرغم من أن الدراسة ما زالت بعيدة كل البعد عن التطبيقات السريرية، وبالرغم من أنها اقتصرت على مجموعة من الأعضاء دون غيرها، مثل أعضاء الجهاز التناسلي والمرتبطة بالتكاثر والخصوبة المهمة في عملية الشيخوخة، فهي تقدم إطارًا يمكِّننا من فهم علاقة الأعضاء ذات الشيخوخة المتسارعة بالأمراض، وخطورة تطورها الذي قد يؤدي إلى الوفاة.
المراجع
1. Oh HS-H, Rutledge J, Nachun D, Pálovics R, Abiose O, Moran-Losada P, Channappa D, Urey DY, Kim K, Sung YJ, et al. 2023. Organ aging signatures in the plasma proteome track health and disease. Nature. 624(7990):164–172.
2. Gilbert SF. 2019. Aging: The Biology of Senescence. Nihgov. https://www.ncbi.nlm.nih.gov/books/NBK10041/.
3. Schaum N, Lehallier B, Hahn O, Pálovics R, Hosseinzadeh S, Lee SE, Sit R, Lee DP, Losada PM, Zardeneta ME, et al. 2020. Ageing hallmarks exhibit organ-specific temporal signatures. Nature. 583(7817):596–602.
4. Almanzar, N. et al. 2020. A single-cell transcriptomic atlas characterizes ageing tissues in the mouse. Nature 583, 590–595.
5. Róbert Pálovics, Keller A, Schaum N, Tan W, Fehlmann T, Jerico M, Kern F, Bonanno L, Kruti Calcuttawala, Webber JT, et al. 2022. Molecular hallmarks of heterochronic parabiosis at single-cell resolution. 603(7900):309–314.
6. Zahn JM, Poosala S, Owen AB, Ingram DK, Lustig A, Carter A, Weeraratna AT, Taub DD, Gorospe M, Mazan-Mamczarz K, et al. 2007. AGEMAP: A Gene Expression Database for Aging in Mice. Frankel WN, editor. PLoS Genetics. 3(11):e201.