مقدمة
في عام 1907 وُلِد في مدينة »كورال جيبلز» (Coral Gables) في ولاية »فلوريدا« ((Florida الأمريكية صبي يدعي »كورتيس كونرز« (Curtis Connors). اتسم الصبي منذ الصغر باهتمامه الشديد بعلوم الأحياء والطب مما دفعه عند بلوغه سن الجامعة إلى الالتحاق بكلية الطب، فتفوق في قسم الجراحة ونال بعدها درجة الدكتوراة المزدوجة في تخصُّصَي «علم الزواحف والبرمائيات» (Herpetology) و«الكيمياء الحيوية» (Biochemistry).
بدأ دكتور كونرز بممارسة مهنة الجراحة التي أصبح متميزًا بها وذاع صيته فيها على مستوى عالمي. وبالإضافة إلى مهنة الجراحة، نما معه اهتمام بحثي شديد تجاه الزواحف نتيجةً لتخصصه في مرحلة الدكتوراة، فكان مفتونًا بقدرة بعض الزواحف الهائلة على تجديد أجزاء معقدة من جسدها مثل الذيل في كثير من أنواع «السحالي» (Lizards) وعديد من أنواع «أبو بريص – البرص بالعامية» (Geckos).
ظل دكتور كونرز على ذلك الحال، يزداد كل يوم شهرةً وعلمًا حتى حلول عام 1942، ثم بدأ كل شيء بعد ذلك يأخذ منعطفًا نحو الأسوأ. ففي سبتمبر عام 1939 دقت طبول الحرب العالمية الثانية وتم استدعاء دكتور كونرز لأداء الواجب تجاه وطنه، ونظرًا لكون دكتور كونرز جراحًا بارعًا ومتميزًا؛ قضى فترة عمله في الجيش في ذلك الوقت بصفته طبيبًا عسكريًا متخصصًا في العمليات المستعصية للجنود المصابين بإصابات بالغة في ساحات المعركة، فكان يجب عليه أن يبقى قريبًا بدرجة كبيرة من مناطق الاشتباك لتنفيذ عمليات البتر السريع للأطراف المتضررة وإيقاف أي نزيف واضح بالإضافة إلى بعض البدائيات مثل الإنعاش القلبي الرئوي وغيرها.
إلى أن جاء يوم 25 ديسمبر عام 1942، وأثناء أداء دكتور كونرز عمله، تم قصف الخيمة الطبية التي يعمل بها بصواريخ قوات المحور مما أدى إلى اختفاء الرؤية تدريجيًا من عينه ومن ثم فقد وعيه وسط ضوضاء وصراخ الجنود المصابين.
بعد بضعة أيام من الحادث، استيقظ دكتور كونرز مصابًا ببعض الخدوش والرضوض، ومن ثم شعر بالعطش فمد يده اليمني ليلتقط كأسًا من الماء وإذا به يصعق مما رأى فلم يجد ذراعه بدايةً من السواعد، إذ فقدها في الحادث الأليم.
تم ترحيل دكتور كونرز إلى منزله مبتورةٌ أحلامه بعد أن ضاعت حياته المهنية كجراح واعد نتيجةً لفقده ذراعه اليمنى. وبعد فترات صعبة من الصراعات النفسية والاكتئاب، قرر دكتور كونرز التركيز على مجاله البحثي ودراسة «الآليات الجزيئية» ((Molecular Mechanisms التي تُمكِّن بعض الكائنات، مثل الزواحف، من تجديد «أنظمة متداخلة معقدة» (Complex Integrated Systems) في جسدها.
بدأ دكتور كونرز دراسته على نوع من أنواع السحالي يسمى بـ «سحلية الحائط الشائعة» (Common Wall Lizard) -باللاتينية (Podarcis Muralis)- وتعمق في فهم الآليات الجزيئية الدقيقة المتبعة في خلاياها لإتمام عمليات تجديد كاملة لأجزاء مثل الذيل وأطراف الأصابع.
أثناء أبحاث دكتور كونرز، بدأت تتسرب له فكرة أنه يريد محاولة تطبيق فهمه لآليات التجديد في هذا النوع من السحالي على كائن فاقد لتلك القدرة العالية على التجديد. وبعد عديد من التجارب على الفئران وغيرها من الثدييات، قرر دكتور كونرز أنه قد حان الوقت لدمج حمضه النووي مع الحمض النووي الخاص بذلك النوع من السحالي في تجربة غير أخلاقية آملًا أن يكتسب نفس القدرة العالية على التجديد واستعادة ذراعه التي تم بترها إثر الحادث الأليم، ولكن بالطبع نعرف كيف انتهى الأمر بدكتور كونرز؛ فكان نصيبه أن يصبح «الشرير الخارق» (Super Villain) في العدد السادس عام 1963 من كتاب القصص المصورة «الرجل العنكبوت المذهل» (The Amazing Spiderman) وتحول بالكامل إلى سحلية.
ولكن دعونا نناقش حالة دكتور كونرز ونفكر بها كأنها حقيقة، هل لدينا نحن البشر أي «قدرات تجديدية» (Regenerative Ability)؟ وهل بالفعل اختار دكتور كونرز «النموذج الحيواني» (Animal Model) المناسب لخدمة غرضه؟ وهل مزج حمضنا النووي مع الحمض النووي لحيوان آخر هو السبيل الوحيد للحصول على «قدرات تجديدية خارقة» (Super Regenerative Ability)، أم هناك طرق أخرى؟ سوف نحاول الإجابة على تلك الأسئلة ومعرفة لماذا كانت تجارب دكتور كونرز محكومًا عليها بالفشل منذ البداية.
القدرات التجديدية في البشر
في بداية الموضوع، لنناقش ما حدودنا كبشر؛ هل لدينا أي قدرات تجديدية؟ وإلى أي مدى يمكن الاعتماد عليها؟
إذا أجرينا بحثًا بسيطًا عن مفهوم كلمة التجديد في علم الأحياء؛ سيظهر لنا أن المقصود بالتجديد هو قدرة الكائن الحي الذاتية على تعويض أو استبدال الخلايا أو الأنسجة أو الأعضاء أو حتى أجزاء كاملة من الجسم، بأخرى جديدة تؤدي وظيفة الجزء التالف أو المفقود على أكمل وجه، ويمكن تصنيف القدرات التجديدية في الكائنات الحية إلى ثلاثة أنواع:
النوع الأول: «التجديد الشامل للجزء المفقود» (Epimorphic Regeneration):
التجديد الشامل؛ من الاسم يتضح أنه قدرة الكائن الحي على تعويض الأجزاء المفقودة أو التالفة منه -مهما كانت درجة تعقيدها- بأجزاء أخرى سليمة مماثلة لها في الشكل والوظيفة، معتمدًا على تخليق وإنماء خلايا جديدة ذات «قدرات تكاثرية عالية» (High Proliferative Ability) بعد أن تمر خلايا الجسم الأساسية بمرحلة «فقد التمايز» (Dedifferentiation).
تستطيع الكائنات التي تمتلك تلك القدرة على التجديد أن تستعيض أعضاء وأطراف كاملة الوظيفة والشكل حتى بعد فقدان 100% منها، كما أن معظمها يمتلك القدرة على تكوين ما يُعرَف بـ «المأرمة» (Blastema)، وهي عبارة عن كتلة من الخلايا غير المتمايزة التي تتكون غالبًا بعد عملية فقد التمايز، ويمكن أن تنمو منها أنظمة متداخلة معقدة، مثل الأطراف والأعضاء المختلفة.
النوع الثاني: «التجديد بهدف استكمال الشكل» (Morphallaxis Regeneration):
يعتمد هذا النوع من التجديد على «إعادة التنميط» (Repatterning) للخلايا الموجودة، أي إعادة الخلايا الموجودة في الكائن الحي للنمط السابق قبل الإصابة أو الفقد، كما أنه لا يحدث إنماء لخلايا جديدة بشكل كبير، على عكس النوع السابق ذكره.
النوع الثالث: «التجديد بهدف محاولة الاستعاضة» (Compensatory Regeneration):
عند حدوث أي تلف أو ضرر على مستوى الأعضاء، تبدأ الخلايا بالانقسام بشكل كبير لتعوض الجزء التالف، ولكن لا يحدث فقد للتمايز مثل النوع الأول أو إعادة تنميط مثل النوع الثاني، لذلك يعتبر هذا النوع هو الأكثر محدودية والأكثر شيوعًا بين الكائنات الحية، فإذا تضرر عضو ما بدرجة معينة يمكن إصلاح الضرر، ولكن لا يمكن استعاضة العضو كاملًا كما كان أو استعاضة الأشكال المفقودة بدرجة دقيقة.
تتفاوت القدرات التجديدية لدى الكائنات الحية، فمثلًا تندرج قدراتنا التجديدية -نحن البشر- تحت التصنيف الأقل مرتبة، ألا وهو التجديد بهدف محاولة الاستعاضة. يمكن رؤية بعض من قدرات أجسادنا التجديدية يوميًا في مواقف عدة، فعلى سبيل المثال، عند احتكاك أجسادنا بأسطح خشنة وتكون جرح خارجي بسيط أو حتى عند تبديل الملابس نفقد جزءًا من الطبقة الخارجية لخلايا الجلد التي تدعى «البشرة» (Epidermis)، ولكن بفضل وجود «خلايا جذعية مخصصة« (Epidermal Stem Cells) لتجديد الخلايا التي تفقد من تلك المنطقة، تظل منطقة البشرة في الجلد بحالة صحية، ودائمًا ما تتجدد مع الوقت حتى إذا لم يكن هناك أي مؤثر خارجي.
يعتبر تجديد طبقات الجلد نوعًا من أنواع «التجديد الفيسيولوجي» (Physiological Regeneration)، أي أنه يحدث طبيعيًا دون أي حاجة إلى مؤثر خارجي. قد يحدث هذا التجديد بدرجة أكبر عند وجود مؤثر خارجي، ولكن إن لم يوجد، فسيحدث في الحالة الطبيعية للجسم، مثله مثل تجديد وإنتاج كرات الدم في الجسم؛ فحتى إن لم يفقد الشخص كمًا من دمه، سيتم استبداله وتجديده في فترة من 6 إلى 8 أسابيع.
نلاحظ أنه على المستوى الخلوي -باستثناء الخلايا العصبية خاصةً الطرفية منها- يمكننا الاعتماد على قدراتنا التجديدية، فيمكن تجديد الخلايا التالفة والمفقودة من الأعضاء والأنظمة الحيوية، ولكن ذلك أيضًا ليس في المطلق، أو يكون في حدود ضيقة إلى حدٍ ما، أما على مستوى الأعضاء الكاملة فتبدأ قدراتنا التجديدية بخذلاننا، فلا يمكن إزالة عضو كامل من بدايته حتى نهايته وننتظر منه أن ينمو من جديد، باستثناء الكبد فقط، إذ يرجع إلى حجمه ووظائفه وشكله الطبيعي حتى بعد فقدان 90% منه، أما إذا تمت إزالته كله فلا ينمو مرة أخرى.
نماذج حيوانية مناسبة لدراسة تجديد الأنظمة المعقدة
استعرضنا في الفقرة السابقة مفهوم التجديد في علم الأحياء وتصنيفاته الأساسية، كما استعرضنا بعضًا من قدرات جسدنا المحدودة على التجديد، مما يجعلنا نتأمل ونسأل: هل يمكن أن نوسع حدود تلك القدرات ونرتقي بها من مرتبة «التجديد بهدف محاولة الاستعاضة» إلى «التجديد الشامل للجزء المفقود»؟ هل يمكن في يوم ما أن يتحقق حلم دكتور كونرز فيصبح الوقت هو طبيب ضحايا حوادث البتر المختلفة؛ فقط ينتظرون حتى تنمو أطرافهم مجددًا فيعودون مرة أخرى إلى ممارسة أعمالهم بصورة طبيعية دون التأثير على جودة حياتهم.
للإجابة على ذلك السؤال يجب علينا أن نرى نماذج من الطبيعة لديها قدرات تجديدية خارقة لأنظمة حيوية معقدة ومتداخلة تندرج تحت «التجديد الشامل للجزء المفقود» لنتعلم ونفهم كيف تقوم أجساد تلك الكائنات بذلك.
من الكائنات اللافقارية التي تندرج قدراتها التجديدية تحت «التجديد الشامل للجزء المفقود» نوع من أنواع الديدان المفلطحة تدعى «المستورقات» (Planaria). تمتلك تلك الديدان القدرة على تجديد وتعويض الأجزاء المفقودة من جسدها مهما كانت درجة تعقيدها؛ فلديها قابلية على تجديد الرأس، والذيل، والأنظمة الداخلية أيًا ما كانت، كما هو موضح في الشكل رقم (3).
تعتبر ديدان المستورقات كائنات بسيطة في الشكل بالمقارنة مع الحيوانات الفقارية، إلا أنها على درجة عالية من التعقيد، فكل جزء من الرأس أو الذيل يتم تجديده مرة أخرى يحتوي على العديد والعديد من الأنسجة والخلايا المختلفة، فهي تمتلك أجهزة حيوية متداخلة على درجة من التعقيد مثل الجهاز العصبي والجهاز الهضمي، كما هو موضح بالشكل رقم (4).
في كل مرة يحدث فقد أو جرح لديدان المستورقات، يقوم الجزء السليم من الجسد بتجديد ما فُقِد بشكل مماثل تمامًا لما كان عليه، على الرغم من اختلاف وتداخل الأنظمة في الجزء المفقود، ومع ذلك ينجح هذا النوع من الديدان في كل مرة باستعاضة ما فقده، ويرجع ذلك لتكوين المأرمة في كل مرة تتعرض فيها هذه الديدان لجرح أو إصابة، بالإضافة إلى أن نحو 30% من جسد هذه الديدان يتكون من خلايا غير متمايزة تدعى «نيوبلاست» (Neoblast)، حالها حال الخلايا الجذعية لدينا، إذ يمكنها التمايز إلى أي نوع من أنواع الخلايا في الجسد وتعويض ما تم فقده.
تعد الأجهزة والأنظمة الحيوية لديدان المستورقات بسيطة مقارنةً بالإنسان، إلا أنها تقدم نموذجًا حيوانيًا مناسبًا لدراسة التواصل الخلوي بين أجزاء الجسم المختلفة خلال عملية التجديد، ودراسة الإشارات الخلوية بسهولة بين الأنسجة المختلفة، وذلك نظرًا لصغر حجمها وبساطة تركيبها مقارنةً بكثير من النماذج الحيوانية الأخرى.
في حال أردنا رؤية نموذج أكثر تعقيدًا من حيث التركيب ويمتلك قدرات تجديدية عالية، كما أنه يمتلك نفس مميزات ديدان المستورقات من حيث الحجم، يمكننا دراسة التجديد في «يرقات الضفادع» (Tadpole Larvae). ففي الأعمار المبكرة لليرقات، تكون القدرات التجديدية لها في أعلى المستويات، إذ تكون اليرقة قادرة على تجديد الأطراف المفقودة، والعين، والمخ، والذيل، والقلب، ولكن مع مرور الوقت والنمو، تبدأ اليرقات في فقدان خواصها التجديدية تدريجيًا، وتبدأ خلاياها بفقدان خواصها الجنينية، ويتطور جهازها المناعي و يصبح أكثر تعقيدًا، فيحاول الجسم إغلاق الجروح بسرعة أكبر مما يؤدي إلى تكوين «ندبة» ((Scar بدلًا من المأرمة، حتى تصل إلى شكل الضفدع كامل النمو الذي تكون قدراته التجديدية محدودة بالمقارنة بما كانت عليه، كما هو موضح بالشكل رقم (5).
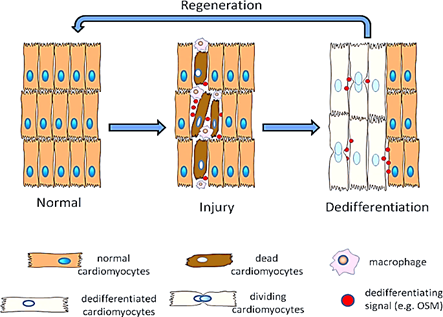
إذا أردنا أن نزيد من درجة التعقيد ونقترب من الوضع الذي تكون عليه أجسادنا، يجب علينا دراسة كائنات تمتلك قدرات تجديدية عالية وهي في حالة «الكائن مكتمل النمو» (Fully Developed Organism)، وهنا قد تتبادر إلى أذهاننا «سمكة الزرد» (Zebra Fish) القادرة على تجديد عضلات القلب واستعادة شكله، وتجديد المخ، وحتى زعانفها، أو سيتبادر إلى أذهاننا -مثلما تبادر لدكتور كونرز- عائلة «الزواحف» (Reptiles)، فكثير من أنواع أبو بريص والسحالي لديها القدرة على تجديد أذيالها وهي كائن مكتمل النمو، ولكن هناك عائلة أخرى لديها قدرات تجديدية أعلى وأوسع في حالة النمو الكامل للجسم وهي عائلة «الذيليات» ((Urodeles.
تندرج الذيليات تحت عائلة البرمائيات وتضم أنواعًا من «السمندل» (Salamanders)، ويعتبر سمندل «الأكسولوتل» (Axolotl) أو «السمندل المكسيكي» (Mexican Salamander) من أكثر الكائنات الحية ذات القدرات التجديدية العالية مقارنةً بدرجة تعقيده، فلديه القدرة على تجديد واستعاضة أي جزء مفقود أو مصاب من أجزاء جسده بصورة كاملة حتى عندما يصبح كائنًا مكتمل النمو -الشكل رقم (6)-، ويعتبر من أكثر النماذج الحيوانية المستخدمة حديثًا في عديد من الدراسات الخاصة بعلوم التجديد والشيخوخة.
مقارنة بين الآليات المتبعة في أجساد الفقاريات العليا في حالة فقد أجزاء معقدة من أجسادها، والآليات المتبعة في أجساد الذيليات
بعدما استعرضنا أهم النماذج الحيوانية المناسبة لدراسة تجديد الأنظمة المعقدة، سنقارن كيفية تفاعل وتفكير أجسادنا مع فقد أنظمة متداخلة معقدة مثل الأطراف، مقارنةً بما تفعله أجساد كائنات مثل سمندل الأكسولوتل.
فدعونا نتخيل كيف استجاب جسد دكتور كونرز للحادث المأساوي بالمقارنة بما كان سيكون الوضع عليه لو كان يمتلك القدرات التجديدية لسمندل الأكسولوتل، وسندعوه بـ «دكتور كونرز المحسَّن» (Enhanced Dr. Connors).
في حالة دكتور كونرز الطبيعية؛ عند حدوث الانفجار، وبسبب الضغط العالي الواقع على جزء صغير من الجسم (الذراع)، لم تتحمل الأنسجة والأربطة هذا الكم من الضغط، فانفصل وتهتك هذا الجزء تاركًا الخلايا المتبقية في حالة صدمة مع جرح عظيم وكثير من النزيف.
في هذه الحالة ستكون أولويات الجسم هي التعامل مع الجرح الذي نتج عن الانفجار، مع فقدان «الذاكرة المكانية» (Spatial Memory) للجرح، وموقع حدوثه بالضبط، وماهية الجزء الذي تم فقده. سيكون التعامل مع الطرف المبتور على أنه مجرد إصابة فقط دون وضع أي اعتبار لما تم فقده.
بعد تلقي الصدمة، تبدأ مرحلة الاستشفاء للخلايا المتضررة مثل العظام، والأوتار، والعضلات، وطبقات الجلد. تتكون مراحل استشفاء الجرح من ثلاث مراحل متداخلة ألا وهي: مرحلة «الالتهاب» (Inflammation)، ومرحلة «التكاثر الخلوي» (Proliferation)، ومرحلة «النضج الخلوي» (Cellular Maturation).
المرحلة الأولى «الالتهاب»:
تحدث تلك المرحلة مباشرةً بعد حدوث الجرح، وتستمر من 4 إلى 6 أيام. بعد حدوث الصدمة، يحدث انقباض في الأوعية الدموية لتقليل فقد السوائل، ومن ثم تبدأ الصفائح الدموية في التراكم وتكوين جلطات لمنع فقد الدم من الجسم.
بعد ذلك تبدأ الصفائح الدموية بإفراز بروتينات تعرف باسم الـ «السيتوكينات» (Cytokines) بالإضافة إلى «عوامل النمو» (Growth Factors)، حيث تساعد كلٌ منها على تحفيز «الاستجابة الالتهابية» (Inflammatory Response).
يبدأ تكوين الجلطات في استقطاب «الخلايا البالعة الكبيرة» (Macrophages) بتكوين نوع من أنواع البروتينات تدعى «الإنزيمات المعتمدة على المعادن المُحلِّلة لبروتين ما بين الخلايا» (Matrix Metalloproteinases, MMPs)، التي تعمل على تجميع الكولاجين من الخلايا المتضررة. بعد ذلك يبدأ تحفيز عمليات تكوين خلايا «النسيج الظهاري» (Epithelium) المكونة لطبقة البشرة مرة أخرى، فيما يعرف بعملية «إعادة تشكل النسيج الظهاري» (Re-epithelization).
المرحلة الثانية «التكاثر الخلوي»:
تبدأ تلك المرحلة من اليوم رقم 4 إلى اليوم رقم 14، وتتضمن استكمال عمليات إعادة تشكل النسيج الظهاري عن طريق تكاثر الخلايا السليمة الموجودة على جوانب الجرح لتكوين حاجز مناعي لمنع دخول البكتيريا وإيقاف فقد السوائل، ومن ثم بعد ذلك تبدأ عمليات تكاثر ونمو الأوعية الدموية المصابة واستشفائها ((Angiogenesis.
المرحلة الثالثة «النضج الخلوي»:
تكون بداية تلك المرحلة من اليوم رقم 8 إلى سنة كاملة بعد الإصابة، وتتضمن تلك المرحلة تكوين «وسط جديد خارج الخلية» (Extracellular Matrix) يتكون من الـ «الفيبرين» (Fibrin) والـ «فيبرونيكتين» (Fibronectin)، ومن ثم يترسب عليه الكولاجين تدريجيًا حتى تتكون ندبة.
كانت تلك الخطوات الطبيعية التي سيقوم بها جسد دكتور كونرز الطبيعي، أما في حالة اكتسابه صفات سمندل الأكسولوتل، ستتغير الخطوات المتبعة في جسده إثر التعرض للبتر.
دكتور كونرز المحسَّن:
إذا كان دكتور كونرز يمتلك الخواص التجديدية لسمندل الأكسولوتل، كان جسده سيتعامل مع الجزء المفقود على أنه أكثر من مجرد جرح، ففي هذه الحالة سيكون لدى جسده ما يعرف بالذاكرة المكانية، أي أن لدى خلايا الجسد الوعي الكافي لفهم أن هناك جزءًا تم فقده، لذلك يجب عليه العمل لتعويضه وليس فقط لإغلاق الجرح.
في هذه الحالة كانت ستكون هناك خطوات مختلفة متداخلة يتبعها الجسد للتعامل مع الفقد، وهي كالتالي: المرحلة الأولى «استشفاء الجرح» (Wound Healing)، المرحلة الثانية وهي «فقد التمايز»، والمرحلة الأخيرة «إعادة الإنماء» (Re-development).
المرحلة الأولى «استشفاء الجرح»:
بعد مرور 12 ساعة من حدوث الجرح، تبدأ خلايا النسيج الظهاري الهجرة من أطراف الجرح إلى المنطقة المكشوفة من الجرح مكونة ما يعرف بالنسيج الظهاري للجرح، وهي طبقة سريعة التكوين الهدف منها منع تدمير الخلايا السليمة الباقية، ومنع حدوث العدوى، بالإضافة إلى تقليل حدوث الالتهاب.
نلاحظ أن إغلاق الجرح حدث في 12 ساعة فقط، وهي فترة تعتبر أقل بكثير مقارنةً بما يحدث في حالة أجسادنا.
المرحلة الثانية «فقد التمايز»:
تبدأ تلك المرحلة من اليوم رقم 6 إلى اليوم رقم 20، وفيها تبدأ خلايا النسيج الظهاري للجرح بزيادة سمكها مكونةً ما يعرف بـ «غطاء النسيج الظهاري» (Apical Epithelial Cap) كبداية لتكوين المأرمة، ومن ثم تبدأ الخلايا في فقد صفاتها تدريجيًا خلال مرحلة فقد التمايز، وبعد ذلك يبدأ تنشيط الجينات المسؤولة عن التجديد مرة أخرى.
المرحلة الثالثة «إعادة الإنماء»:
في هذه المرحلة، بعد تفعيل الجينات الخاصة بالتجديد، يبدأ الجسم في التعامل على أنه يُنمِّي يدًا من جديد مثلما حدث أثناء التكوين الجنيني، مُفعِّلًا كل «مسارات النمو» ((Developmental Pathways الخاصة بتلك العملية من جديد.
الحصول على قدرات تجديدية خارقة
إذا أجرينا تجارب دكتور كونرز في الحقيقة، سنكتشف المفاجأة المخيبة للآمال؛ أنه لن يحدث أي شيء خارج عن المألوف ولن نكتسب أي قدرات خارقة، ولكن لماذا؟
لأنه ببساطة، المبدأ الأساسي وراء تلك التجارب هو دمج الحمض النووي لخلايانا مع الحمض النووي الخاص بكائن ذي قدرات تجديدية عالية، وعلى فرض أننا قمنا بمزج حمضنا النووي باستخدام تقنية مثل« كريسبر- كاس 9» (Crisper-Cas9)، فعلينا مزج الحمض النووي الموجود بداخل كل خلية من خلايا جسدنا مع الحمض النووي الجديد، وذلك غير متوفر في وقتنا الحالي، فنحن غير قادرين على استهداف خلايا جسدنا كلها وتعديلها دفعة واحدة، بالإضافة إلى أن خلايانا متمايزة، أي أن كل خلية لديها صفات واضحة وصريحة، ويرجع ذلك إلى وجود مجموعة من الجينات المميزة لنوع كل خلية؛ هي فقط التي يتم التعبير عنها وتنشيطها، لذلك إذا لاحظنا النماذج الحيوانية السابقة ذات القدرات التجديدية العالية، سنجد أنه -قبل عملية التجديد- تميل الخلايا لفقد هويتها الخلوية عن طريق المرور بمرحلة «عدم التمايز».
ولكننا ذكرنا أن كل نوع من أنواع الخلايا لديه مجموعة من الجينات المميزة له التي تكسبهه صفاته، فكيف يمكن للخلايا -بعد أن تمر بمرحلة عدم التمايز- أن تتمايز إلى أي نوع آخر؟
في الواقع، الحمض النووي الموجود بخلايانا يحتوي على جميع الجينات المميزة لجميع أنواع الخلايا، ويظل متاحٌ التعبير عن تلك الجينات ما لم تتخذ الخلية أي خطوات في طريق التمايز إلى نوع معين، ولكن منذ لحظة اتخاذ الخلية أولى خطواتها تجاه تحديد هويتها، تبدأ مجموعة مخصصة من الجينات لذلك النوع فقط بالتنشيط والتعبير عنها، مع وقف القدرة على التعبير عن باقي الجينات، مما يعطينا إشارة إلى أن خلايا جسدنا كلها -في الواقع- لديها جميع الجينات اللازمة لعمليات التجديد المعقدة، فنحن لا نحتاج إلى أن نمزج أحماضنا النووية مع كائنات أخرى للحصول على تلك الجينات لأنها بداخلنا جميعًا، ولكنها غير مُفعَّلة نظرًا لتمايز خلايانا، فماذا علينا أن نفعل نظريًا حتى يمكننا الحصول على تلك القدرات؟
أولًا: يجب علينا أن نتعلم كيفية إفقاد الخلايا لهويتها، وبالفعل قد خطونا خطوات في ذلك الاتجاه حين تمكن العالم الياباني الحاصل على جائزة نوبل عام 2012 «شينيا ياماناكا» (Shinya Yamanaka) من اكتشاف مجموعة من العوامل التي يمكن تقديمها للخلية فتفقد هويتها وتمر بعملية فقدٍ للتمايز، وسميت باسم عوامل ياماناكا (Yamanaka Factors).
المشكلة في طريقة دكتور ياماناكا أنه يمكن تطبيقها على الخلايا «في المختبر فقط» (In Vitro) ولا توجد طريقة حتى الآن تمكّننا من تطبيق تلك التقنية على مجموعة من الخلايا في موقعها داخل الجسم.
ثانيًا: يجب أن يعرف الجسد ما تم فقده حتى تتم استعادته، وأحد الأشياء التي يمكن أن توفر «معلومات مكانية» (Spatial Information) هو تطبيق الأنماط الحيوية الكهربية التي تحدث في بداية نمو الكائن الحي والتي تكون حصرية وحدثًا مرتبطًا بالنمو.
في تجربة مثيرة، قرر العلماء، بعد دراسة الأنماط الكهربية الحيوية المرتبطة بإنماء الأطراف في الضفدع الإفريقي ذي المخالب أثناء النمو، أن يطبقوا تلك الأنماط على طرف مبتور لضفدع بالغ، وكانت المفاجأة أنه بدلًا من تكوين الشوكة المعتادة، بدأ طرف ذو مظاهر متمايزة بالظهور؛ الشكل رقم (9).
في وقتنا الحالي، نحن نبلي حسنًا بخصوص التجديد على المستوى الخلوي البسيط، أما عن الأنظمة المعقدة فلا تزال الرحلة طويلة، ولكننا نسير في الطريق الصحيح، وقد يتحقق حلم دكتور كونرز في المستقبل القريب.
المصادر
1. https://marvel.fandom.com/wiki/Curtis_Connors_(Earth-616).
2. Alibardi, L. Introduction to the Study on Regeneration in Lizards as an Amniote Model of Organ Regeneration. J. Dev. Biol. 2021, 9, 51. https://doi.org/10.3390/jdb9040051
3.https://www.nigms.nih.gov/education/fact-sheets/Pages/regeneration.aspx#:~:text=Regeneration%20is%20the%20process%20of,maintenance%20of%20tissues%20and%20organs.
4. Hirsch, T., Rothoeft, T., Teig, N. et al. Regeneration of the entire human epidermis using transgenic stem cells. Nature 551, 327–332 (2017). https://doi.org/10.1038/nature24487.
5. Chuong CM, Randall VA, Widelitz RB, Wu P, Jiang TX. Physiological regeneration of skin appendages and implications for regenerative medicine. Physiology (Bethesda). 2012 Apr;27(2):61-72. doi: 10.1152/physiol.00028.2011. PMID: 22505663; PMCID: PMC3620028.
6.https://www.nih.gov/news-events/nih-research-matters/cells-maintain-repair-liver-identified#:~:text=The%20liver%20has%20a%20unique,beyond%20the%20point%20of%20repair.
7. Gilbert SF. Developmental Biology. 6th edition. Sunderland (MA): Sinauer Associates; 2000. Regeneration. Available from: https://www.ncbi.nlm.nih.gov/books/NBK9971/
8. Yao, Y., Wang, C. Dedifferentiation: inspiration for devising engineering strategies for regenerative medicine. npj Regen Med 5, 14 (2020). https://doi.org/10.1038/s41536-020-00099-8
9. Reddien PW. Specialized progenitors and regeneration. Development. 2013 Mar;140(5):951-7. doi: 10.1242/dev.080499. PMID: 23404104; PMCID: PMC3583037.
10. Beck CW, Izpisúa Belmonte JC, Christen B. Beyond early development: Xenopus as an emerging model for the study of regenerative mechanisms. Dev Dyn. 2009 Jun;238(6):1226-48. doi: 10.1002/dvdy.21890. PMID: 19280606.
11. Suzuki M, Yakushiji N, Nakada Y, Satoh A, Ide H, Tamura K. Limb regeneration in Xenopus laevis froglet. ScientificWorldJournal. 2006 May 12;6 Suppl 1:26-37. doi: 10.1100/tsw.2006.325. PMID: 17205185; PMCID: PMC5917240.
12. Beffagna G. Zebrafish as a Smart Model to Understand Regeneration After Heart Injury: How Fish Could Help Humans. Front Cardiovasc Med. 2019 Aug 6;6:107. doi: 10.3389/fcvm.2019.00107. PMID: 31448289; PMCID: PMC6691037.
13. Yokoyama, H. (2008), Initiation of limb regeneration: The critical steps for regenerative capacity. Development, Growth & Differentiation, 50: 13-22. https://doi.org/10.1111/j.1440-169X.2007.00973.x.
14. Otsuki L, Tanaka EM. Positional Memory in Vertebrate Regeneration: A Century’s Insights from the Salamander Limb. Cold Spring Harb Perspect Biol. 2022 Jun 14;14(6):a040899. doi: 10.1101/cshperspect.a040899. PMID: 34607829; PMCID: PMC9248832.
15. The Editors of Encyclopaedia Britannica. “blastema”. Encyclopedia Britannica, 7 Dec. 2018, https://www.britannica.com/science/blastema. Accessed 10 April 2025.
16. Tanabe K, Takahashi K, Yamanaka S. Induction of pluripotency by defined factors. Proc Jpn Acad Ser B Phys Biol Sci. 2014;90(3):83-96. doi: 10.2183/pjab.90.83. PMID: 24621955; PMCID: PMC3997808.
17. Mclaughlin, Kelly & Levin, Michael. (2017). Bioelectric signaling in regeneration: Mechanisms of ionic controls of growth and form. Developmental Biology. 433. 177-0189. 10.1016/j.ydbio.2017.08.032.