جرثومة المعدة: الجسر إلى قرح المعدة.
بقلم: آلاء ممدوح عبد الله إسماعيل الجوهري
تملك الحزن قلبي لعلمي إصابة أحد الأقارب بسرطان المعدة من المرحلة الرابعة، وهي مرحلة متأخرة من المرض، وكان قبل ذلك يعاني من قرحة بالمعدة، وطغت دهشتي على حزني حين أظهرت التحاليل وجود جرثومة المعدة، حينها تملكني الفضول وجاشت التساؤلات بنفسي، ما علاقة جرثومة المعدة بالقرحة والسرطان؟ وكيف لكائن حي بسيط أن يعيش ويتكيف في تلك البيئة الحامضية بالمعدة؟ ولذلك رويت ظمأ فضولي العلمي بالبحث والتنقيب.
جرثومة المعدة هي نوع من البكتيريا الحلزونية الهوائية سلبية الجرام، تستعمر معدة الإنسان بشكل أساسي، ولها هياكل خيطية تساعدها على الحركة (1)، وتستوطن الأنسجة المبطنة للمعدة لدى حوالي نصف سكان العالم (2). ويعود الفضل إلى العالمين «روبن وارين» (Robin Warren) و«باري مارشال» (Barry Marshall) الحائزين على جائزة نوبل 2005 في اكتشاف جرثومة المعدة وأنها المسبب الرئيسي لالتهابات وقرح المعدة (1). وعلى الرغم من أن البكتيريا نفسها ليست مسرطنة، فالعدوى طويلة الأمد تسبب التهابًا مزمنًا بالغشاء المخاطي للمعدة وضمورًا للأغشية المخاطية وهو مقدمة للسرطان، ولذا أدرجتها منظمة الصحة العالمية من العوامل المسرطنة من الدرجة الأولى (3).
تتمكن البكتيريا من إلحاق العدوى بالإنسان عند ترابط عدة عوامل، منها: العوامل الجينية، والبيئية للإنسان، مع شكل وتركيب البكتيريا، بالإضافة إلى سلوكياتنا وعاداتنا اليومية والتي تشكل كنزًا حقيقيًا للبكتيريا، مثل تناول طعام وشراب ملوث وأطعمة محفوظة مملحة، والتدخين وشرب الكحول، والنظام الغذائي غير المتوازن، حيث تجد البكتيريا في عاداتنا السيئة البيئة الخصبة التي تساعدها على البقاء، لذلك يعد انتشار جرثومة المعدة معيارًا للوضع الاجتماعي والاقتصادي والصحي للبلاد فهي تكون أكثر انتشارًا في البيئات الأقل صحةً، وتنتقل عن طريق الفم أو البراز، وتؤدي إلى أمراض مثل: التهاب المعدة المزمن، والقرحة الهضمية، والاثنا عشر التي تصل إلى سرطان المعدة الغدي(4-5).
تعد رحلة الجرثومة إلى المعدة من العجائب البيولوجية التي تتطلب منها النجاح في ثلاث مراحل خلال مسيرتها بالمعدة.
المرحلة الأولى: أن تتغلب على حموضة المعدة بمعامل أس هيدروجيني (pH 1-2). ويمكنها ذلك من خلال إنزيم «اليورياز» (Urease) الموجود داخل البكتيريا والذي ينتج أمونيا بما أنه يقع في بيئة حامضية وبذلك يحافظ على معادلة البيئة الحمضية المحيطة بالبكتيريا وداخلها (pH 6-7) (6).
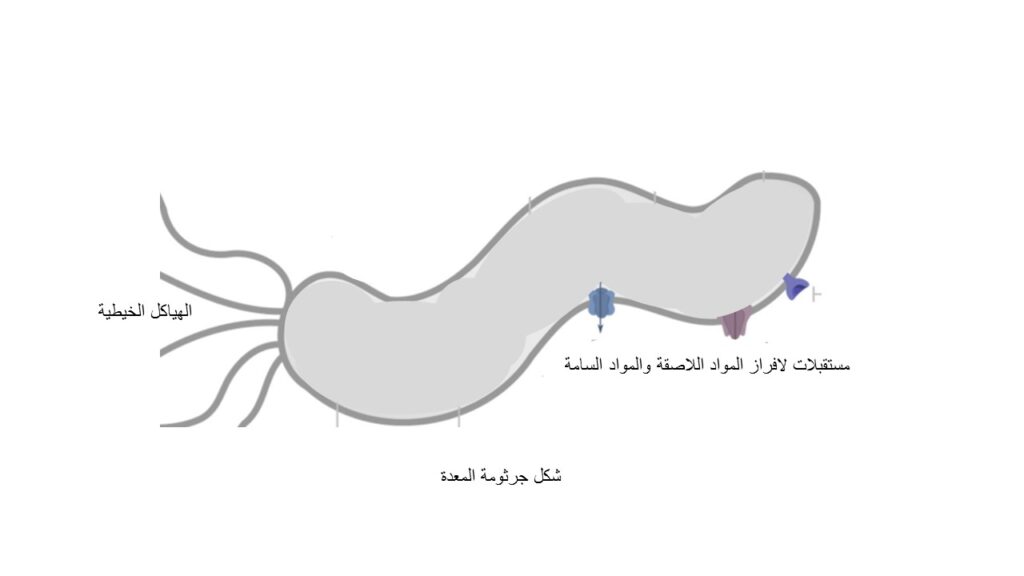
أما المرحلة الثانية: أن تجد طريقها لتصل إلى الخلايا الطلائية للمعدة ثم تلتصق بها، ويساعدها على اجتياز هذه المرحلة الهياكل الخيطية (وهي قدم البكتيريا) التي تعتبر عنصرًا رئيسيًا لتمكين البكتيريا من البقاء لفترة أطول بالمعدة. تتكون الهياكل الخيطية من بروتينات أساسية تمكنها من الهرب من الخلايا المناعية ولهذا السبب تكون الإصابة بالبكتيريا بدون أعراض (7).
أما نظام الانجذاب الكيميائي فيتركز في أنف البكتيريا وهو المحرك للهياكل الخيطية. هذا النظام الكيميائي الفريد يوجه البكتيريا ناحية البيئة المفضلة لنموها والغنية بالحمض الأميني، الأرجنين، واليوريا ومن ثم يبعدها عن المنطقة الضارة التي بها العصارة الصفراوية أو البيئة الحمضية وأنواع الأكسجين التفاعلية (8-9).
تلعب عملية الفسفرة دورًا بارزًا في التفاعل بين نظام الانجذاب الكيميائي وتوجيه الهياكل الخيطية، فحينما تقع البكتيريا في أي من المواد التي تضرها تقوم بإضافة مجموعة فوسفات إلى إحدى بروتينات النظام الكيميائي، ثم تُوجه الهياكل الخيطية للتحرك بعيدًا عن الخطر، فإذا تحركت البكتيريا إلى منطقة أمان بالنسبة لها، تتحرر مجموعة الفوسفات، ويُفك الترابط بين ذلك البروتين والهياكل الخيطية وتكمل البكتيريا طريقها في خط مستقيم(9)، وما إن تستقر البكتيريا في الخلايا الطلائية للمعدة، تتفاعل مع مستقبلات على سطح خلايا المعدة بواسطة مواد لاصقة تفرزها البكتيريا وبهذا تحمي نفسها من الإزاحة وفي ذات الوقت تتمكن من الحصول على العناصر الغذائية والمواد الأيضية لتحسين نموها وتعزيز توصيل موادها السامة (10).
وهنا تأتي مرحلة إطلاق سمومها لتدمير الخلايا، وأشهر موادها السامة يطلق عليها (VacA) وتتراكم في سيتوبلازم الخلايا، حيث يتبب تأثيرات بعيدة المدى على مسارات متعددة في خلايا المعدة بما في ذلك تعطيل وظائف الميتوكوندريا (بيت الطاقة بالخلية)، وتحفيز الالتهام الذاتي وموت الخلايا المبرمَج، وحظر تكاثر الخلايا المناعية (11)، وبهذا تكون قد أتمت مهمتها في العدوى.
وعلى الرغم من إمكانية علاج جرثومة المعدة في مراحلها الأولية بمجموعة مكثفة من المضادات الحيوية، لكن إيمانًا بأن الوقاية خير من العلاج، يجب علينا أن ننتبه لعاداتنا الغذائية والصحية ونحافظ على الأمانة التي حبانا الله بها، ألا وهي الصحة.
المصادر:
Marshall, B. J., & Warren, J. R. (1984). Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. The Lancet, 323(8390), 1311–1315. https://doi.org/10.1016/S0140-6736(84)91816-6
Plummer, M., Franceschi, S., Vignat, J., Forman, D., & De Martel, C. (2015). Global burden of gastric cancer attributable to pylori. International Journal of Cancer, 136(2), 487–490. https://doi.org/10.1002/ijc.28999
Humans, I. W. G. on the E. of C. R. to. (1994). Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans / World Health Organization, International Agency for Research on Cancer, 61, 1–241. Retrieved from https://www.ncbi.nlm.nih.gov/books/NBK487782/
Washington, K. (2010). of the AJCC cancer staging manual: stomach. Annals of Surgical Oncology, 17(12), 3077–3079.
Asaka, M., Sepulveda, A. R., Sugiyama, T., & Graham, D. Y. (2001). Gastric Cancer. In Helicobacter pylori: Physiology and Genetics. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/21290744
Bauerfeind, P., Garner, R., Dunn, B. E., & Mobley, H. L. (1997). Synthesis and activity of Helicobacter pylori urease and catalase at low pH. Gut, 40(1), 25. https://doi.org/10.1136/GUT.40.1.25
Gu, H. (2017). Role of Flagella in the Pathogenesis of Helicobacter pylori. Current Microbiology, 74(7), 863–869.
Ottemann, K. M., & Lowenthal, A. C. (2002). Helicobacter pylori uses motility for initial colonization and to attain robust infection. Infection and Immunity, 70(4), 1984–1990.
Johnson, K. S., & Ottemann, K. M. (2018). Colonization, localization, and inflammation: The roles of H. pylori chemotaxis in vivo. Current Opinion in Microbiology, 41, 51. https://doi.org/10.1016/J.MIB.2017.11.019
Kao, C. Y., Sheu, B. S., & Wu, J. J. (2016). Helicobacter pylori infection: An overview of bacterial virulence factors and pathogenesis. Biomedical Journal, 39(1), 14–23. https://doi.org/10.1016/j.bj.2015.06.002
Zhu, P., Xue, J., Zhang, Z. J., Jia, Y. P., Tong, Y. N., Han, D., … Tang, B. (2017). Helicobacter pylori VacA induces autophagic cell death in gastric epithelial cells via the endoplasmic reticulum stress pathway. Cell Death & Disease 2017 8:12, 8(12), 1–12. https://doi.org/10.1038/s41419-017-0011-x