علم ما فوق الجينات: وسيلةٌ لعلاج بعض الأورام السرطانية
بقلم:سلمى حسين بدري
ما هو علم ما فوق الجينات؟
قام باحثون في عام ٢٠٠٨م بتوفير أنواعٍ مختلفة من الغذاء لمجموعات من إناث الفئران قبل فترة الحمل بأسبوعين، وتركوها تتزاوج مع ذكور نفس النوع من الفئران، واستمروا بإعطائها نفس الأنواع المختلفة من الغذاء طوال فترة الحمل والرضاعة. وكانت النتيجة مُذهِلة، فقد أدى ذلك إلى اختلاف بعض الخصائص الجسدية للفئران الناتجة من التزاوج (مثل لون الفرو والعُرْضة لبعض الأمراض) بالرغم من التطابق الجيني لهذه الفئران (1). وهذا ما يجعل التوءم المتطابق مختلفين في صفاتهما الجسدية أيضًا. نحن هنا نتحدث عن الصفات الوراثية ما فوق الجينية، ولكن ما هو علم ما فوق الجينات؟
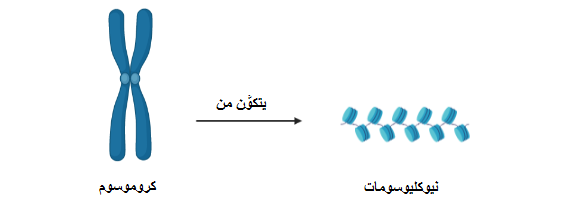
«علم ما فوق الجينات» (Epigenetics): هو علم يصف التغيرات التي تطرأ على مُعدَّلات ترجمة الجينات إلى بروتينات، ولا علاقة له بتغيُّر الشفرة الجينية (2). فمن المعروف أن الجين هو تتابُعٌ من النيوكليوتيدات -وحدات بناء «الحمض النووي» (DNA)- الذي يُمكن لإنزيمات مُعيَّنة قراءته لإنتاج البروتينات (2). أما التغيُّرات ما فوق الجينية فهي تفاعلات كيميائية قد تكون بين موادٍ (مثل الأسيتيل أو الميثيل) والبروتينات التي يلتف حولها شريط الحمض النووي (تُعرَف بالهستونات) (انظر شكل ١ وشكل ٢)، أو قد تحدث هذه التفاعلات بين مجموعات من الميثيل وبعض نيوكليوتيدات السيتوزين بالحمض النووي (3).
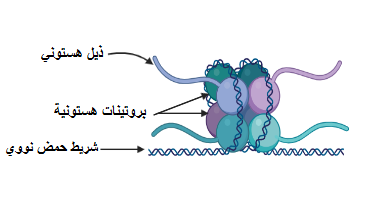
تتحكَّم هذه التفاعلات الكيميائية في ترجمة الحمض النووي إلى بروتينات، حيث يسمح بعضها بعملية الترجمة بينما يمنعها الآخر. مثال على ذلك: ارتباط مجموعات من الأسيتيل بالهستونات مما يؤدي إلى الإنقاص من شحنة الهستونات الموجَبَة، ويَنتُج عن ذلك تنافُرٌ بين الهستونات وشريط الحمض النووي بسبب شحنة الحمض النووي السالبة، وهكذا يتحرر الحمض النووي من قيد الهستونات ومن تعريضه للإنزيمات التي تقوم بقراءة الجينات لتصنيع البروتينات (3). بينما في بعض حالات إضافة مجموعات الميثيل إلى الهستونات، يزيد تقييد الجينات بالهستونات فلا تتمكن الإنزيمات من قراءتها (3) (انظر شكل٣). أمَّا فيما يتعلق بإضافة مجموعات من الميثيل إلى نيوكليوتيدات السيتوزين (في بعض مناطق الحمض النووي التي تُعرَف بـ «جُزُر تتابعات السيتوزين والجوانين»(CpG Islands) )، فإنه يؤدي إلى منع ترجمة الحمض النووي عن طريق بروتين يُسمَّى «مِكبي ٢» (MECP2) الذي يقوم بتقييد شريط الحمض النووي بالهستونات (3) (انظر شكل ٤).
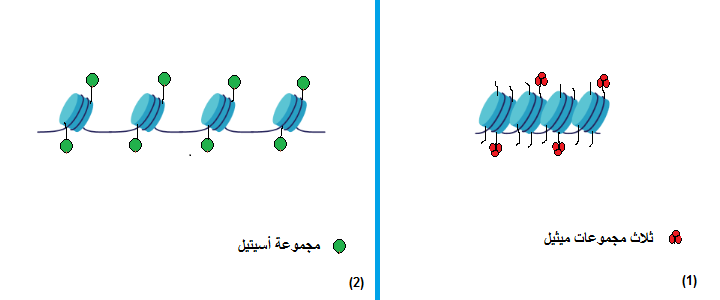
شكل ٣-٢: يوضح أنه عند إضافة الأسيتيل إلى النيوكليوسومات فإن ذلك يؤدي إلى تباعُد النيوكليوسومات عن بعضها تاركةً أماكن حُرة من الحمض النووي مُعرَضةً للإنزيمات التي تترجم الجينات إلى بروتينات.
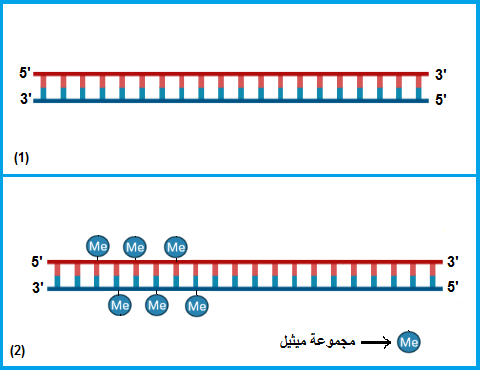
شكل ٤-٢: يوضح شريط حمض نووي مُضاف إليه مجموعات ميثيل – في جزر تتابعات السيتوزين والجوانين – ، عندئذ يقوم بروتين مكبي ٢ بتكديس النيوكليوسومات (غير موَضَّح بالشكل).
وتلعب الإنزيمات دورًا في إضافة وإزالة هذه المجموعات الكيميائية من وإلى الهستونات، كما تعتمد عليها عملية إضافة الميثيل إلى السيتوزين. ويُمكِن تثبيط بعض هذه الإنزيمات أو تنشيطها عن طريق أدوية بعض الأمراض. فقد أجريت دراسة على علاقة عدة أمراض بعلم ما فوق الجينات وأسفرت بعضها عن علاجاتٍ جديدة تعمل على تعديل ما فوق الجينات لعلاج أمراض من بينها سرطانات الدم.
علم ما فوق الجينات وسرطانات الدم
توضح الكثير من الدراساتِ العلاقةَ بين بعض التغيّرات ما فوق الجينية (المذكورة سالفًا) وأنواع من سرطانات الدم. وقد قامت «منظمة الغذاء والدواء» (Food And Drug Administration) بإعطاء التصريح لاستخدام بعض الأدوية التي تعمل على منع أو تفعيل هذه التغيّرات ما فوق الجينية لعلاج أنواع من سرطانات الدم. ومثال ذلك:
١- الأدوية التي تعمل على منع أو تقليل إزالة الأسيتيل من الهستونات، مثل: «سوبيرويلانيليد هيدروكسامات» (Suberoylanilide Hydroxamate) (4) و«روميدبسين» (Romidepsin) (5,6) لعلاج «الورم الليمفي الجلدي للكريات الليمفاوية التائية» (Cutaneous T-Cell Lymphoma)، و«بيلينوستات» (Belinostat)لعلاج «الورم الليمفي المحيطي للكريات الليمفاوية التائية» (Peripheral T-Cell Lymphoma) (7)، و«بانوبينوستات» (Panobinostat) لعلاج «الورم النقوي المتعدِّد» Multiple Myeloma)) (8). حيث يُفتَرَض أن هذا الصنف من «الأدوية ما فوق جينية» (Epigenetic Drugs) يعمل على إعادة تنشيط الجينات المُثبطة للأورام عن طريق زيادة الأسيتيل المرتبط بالهستونات في الأماكن التي تقبع فيها هذه الجينات. في الواقع، هناك طرائق أخرى تعمل بها هذه الأدوية لعلاج سرطانات الأورام، مثل زيادة نسبة الأسيتيل المرتبطة بالبروتين «بي ٥٣» (p53) المُثبِط للأورام، مما ينشط عمله كمضاد للأورام (9)، بالإضافة إلى تأثير بعض هذه الأدوية على بروتين «إي كاي تي» ((AKT الذي يُنقِص بدوره من عُمْر الخلايا السرطانية (10,11).
٢- الأدوية التي تعمل على منع أو تقليل إضافة الميثيل إلى نيوكليوتيدات السيتوزين مما يؤدي إلى تنشيط «الجينات المُثبِّطة للأورام» ((Tumor Suppressive Genes، وتتضمّن هذه المجموعة: «آزاسيتيدين» (Azacitidine) و«ديسيتابن»(Decitabine) (12,13) اللذين يُستَخدمان لعلاج «متلازمة خلل التنسُّج النقوي» (Myelodysplastic Syndrome) كما اعتمدت منظمة الغذاء والدواء استخدام آزاسيتيدين لعلاج «ابيضاض الدم النقوي الحاد» (Acute Myeloid Leukemia) (14).
٣- الأدوية التي تعمل على منع أو تقليل إضافة مجموعات ميثيل إلى الهستونات، مثل: «تازيماتوستات» (Tazematostat) الذي يُستَخدم لعلاج «الليمفومة الجريبية» (Follicular Lymphoma) و«الساركوما الشبيهة بالظهارة» (Epithelioid Sarcoma) (15–18).
الخلاصة
إن علم ما فوق الجينات له تأثير مهم جدًّا على الصفات الجسدية للكائنات الحية ودورٌ في حدوث بعض الأمراض، واستغلال معرفتنا به قد ساعدنا في صنع علاجاتٍ لكثير من الأمراض، كبعض سرطانات الدم.
—————————————————————————————————————
جميع الرسومات التوضيحية الموجودة بالمقال من صنع الكاتب باستخدام موقع Biorender وبرنامجي Paint وPhotoshop.
المراجع
1. Jirtle RL. The Agouti mouse: a biosensor for environmental epigenomics studies investigating the developmental origins of health and disease. Futur Med [Internet]. 2014;6(5). Available from: http://doi.org/10.2217/epi.14.58
2. Carlberg C, Molnár F. Human Epigenetics: How Science Works. Human Epigenetics: How Science Works. Gewerbestrasse: Springer Nature Switzerland; 2019. p. 5–57 and 146.
3. Gibney ER, Nolan CM. Epigenetics and gene expression. Heredity (Edinb). 2010;105(1):4–13.
4. Siegel D, Hussein M, Belani C, Robert F, Galanis E, Richon VM, et al. Vorinostat in solid and hematologic malignancies. J Hematol Oncol. 2009;2:1–11.
5. Iyer SP, Foss FF. Romidepsin for the Treatment of Peripheral T-Cell Lymphoma. Oncologist. 2015;20(9):1084–91.
6. Romidepsin (NDA: 208574) [Internet]. [cited 2023 Jun 11]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/208574Orig2lbl.pdf
7. Campbell P, Thomas CM. Belinostat for the treatment of relapsed or refractory peripheral T-cell lymphoma. J Oncol Pharm Pract. 2017;23(2):143–7.
8. Laubach JP, Moreau P, San-Miguel JF, Richardson PG. Panobinostat for the treatment of multiple myeloma. Clin Cancer Res. 2015;21(21):4767–73.
9. Mrakovcic M, Kleinheinz J, Fröhlich LF. P53 at the crossroads between different types of hdac inhibitor-mediated cancer cell death. Int J Mol Sci. 2019;20(10).
10. Chen CS, Weng SC, Tseng PH, Lin HP, Chen CS. Histone acetylation-independent effect of histone deacetylase inhibitors on Akt through the reshuffling of protein phosphatase 1 complexes. J Biol Chem [Internet]. 2005;280(46):38879–87. Available from: http://dx.doi.org/10.1074/jbc.M505733200
11. Atadja P. Development of the pan-DAC inhibitor panobinostat (LBH589): Successes and challenges. Cancer Lett [Internet]. 2009;280(2):233–41. Available from: http://dx.doi.org/10.1016/j.canlet.2009.02.019
12. Sharma S, Kelly TK, Jones PA. Epigenetics in cancer. Carcinogenesis. 2009;31(1):27–36.
13. Plimack ER, Kantarjian HM, Issa JP. Decitabine and its role in the treatment of hematopoietic malignancies. Leuk Lymphoma. 2007;48(8):1472–81.
14. Onureg (NDA: 214120) [Internet]. [cited 2023 Jun 12]. Available from: https://www.businesswire.com/news/home/20200901005914/en/U.S.-Food-and-Drug-Administration-Approves-Onureg®-azacitidine-tablets-a-New-Oral-Therapy-as-Continued-Treatment-for-Adults-in-First-Remission-with-Acute-Myeloid-Leukemia
15. Julia E, Salles G. EZH2 inhibition by tazemetostat: Mechanisms of action, safety and efficacy in relapsed/refractory follicular lymphoma. Futur Oncol. 2021;17(17):2127–40.
16. Simeone N, Frezza AM, Zaffaroni N, Stacchiotti S. Tazemetostat for advanced epithelioid sarcoma: current status and future perspectives. Futur Oncol [Internet]. 2020;17(10). Available from: https://doi.org/10.2217/fon-2020-0781
17. FDA granted accelerated approval to tazemetostat for follicular lymphoma [Internet]. [cited 2023 Jun 12]. Available from: https://www.fda.gov/drugs/fda-granted-accelerated-approval-tazemetostat-follicular-lymphoma
18. Tazverik (NDA: 211723) [Internet]. [cited 2022 Feb 13]. Available from: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=211723