الهوية الخلوية
النواة ومركزية التحكم الخلوي
يتكون جسم الإنسان في المتوسط مما يزيد عن مئة تريليون خلية، لكلٍّ منها الجينوم نفسه، إلا أنّها تتمايز عن بعضها بعضًا مُشكِّلةً أكثر من مئتي نسيج مختلف هيكليًا ووظيفيًا. فمن المسؤول عن تلك الهوية الفريدة للنسيج؟ وما دور الترتيب الهيكلي للجينوم؟ وكيف يمكن استغلالها في العلاج الخلوي وزراعة الأعضاء؟ [1]
تحوي الخلية الكثير من «العضيَّات» (Organelles)، مثل السيتوبلازم والميتوكوندريا وجهاز جولجي، وتجمع بينها علاقة تآزرية تهدف إلى إنتاج الطاقة وتخليق البروتينات اللازمة للاستقرار الحيوي. هنا يأتي دور النواة، ليس في حملها للمادة الوراثية فحسب، بل يكمن الدور الأهم في تنظيم العمليات التخليقية والتكيفية وإتمام ذلك في تناغم سلس بين كل تلك الأجزاء وبعضها. تتطلب هذه الخصائص مستوى عالٍ من التعقيد البنيوي والديناميكي مما يجعل البعض يرى أن علاقة النواة بالخلية لا تقل محورية عن علاقة المخ بالجسم، كما أن كليهما يحمل غموضًا لم يُكتشَف بعد. [1,2]
بعد ثلاثة عقود من تطور تكنولوجيا البيولوجيا الجزيئية، أصبح من الجلي أنّ «التعقيد الحيوي» (Biological Complexity) لا يعتمد على عدد الجينات التي يمتلكها النوع، إذ إن عدد الجينات لدى «برغوث الماء» (Daphnia) يقارب 31,000 جين مقابل 23,000 جين لدى البشر [3]، ولا يعتمد حتى على مدى تشابه تسلسل الحمض النووي. فمثلًا، تمتلك حيوانات «الشمبانزي» (Chimpanzee) ما يقارب 99% من نفس التسلسل الجيني للبشر، ومع ذلك توجد بيننا وبينها فجوات معرفية وسلوكية ضخمة. يعكس هذا اعتماد التعقيد على شيء أعمق من إسناده لعدد الجينات أو لمدى تطابق تسلسله، وعليه اتجهت الأبحاث نحو فهم الآليات التي تنظم عملية «التعبير الجيني» (Genetic Expression) دون تغيير في تسلسل الشفرة الوراثية، فيما يعرف بعلم «الوراثة فوق الجينية» (Epigenetics).
الترتيب الهيكلي للمادة الوراثية
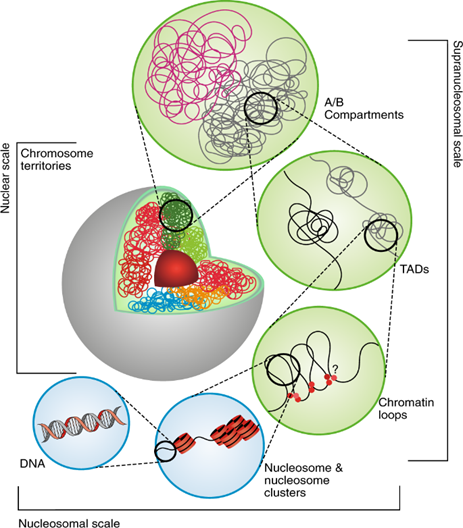
كأي نظام حيوي، تعد نواة الخلية غاية في التعقيد والتنظيم في آنٍ واحد؛ حيث تحوي داخل غشائها النووي عنصرين رئيسيين هما «النُويَّة» (Nucleolus) التي تتوزع حولها المادة الوراثية وتترتب على عدة مستويات تنظيمية، ومن المعلوم أنّ لكل خلية بشرية 23 زوجًا من الكروموسومات، ولكن لا تظهر المادة الوراثية بهذه البنية إلا أثناء «الانقسام الخلوي» (Mitosis). بمجرد انتهاء أطوار الانقسام واستقرار الخلية، تدخل «الطور البيني» (Interphase)، حيث تتفكك الكروموسومات حول النُويَّة مُشكِّلةً مواقع أو مناطق تُعرَف باسم «مناطق الكروموسومات» (Chromosome Territories) كما يظهر بالشكل (1)؛ حيث يكون لكل منطقة لون مميز يبين حدود انتشارها في الوسط النووي. عند فحص بنية منطقة كل كروموسوم، نجد أنّها تنفصل مكانيًا لتشكل منطقتين مستقلتين، تحمل إحداها «الجينات النشطة» (A-Compartment)، والأخرى تحمل «الجينات غير النشطة» (B-Compartment)، وذلك يسهِّل الوصول إلى مجموعة محددة من الجينات، كما يمنع الوصول إلى البعض الآخر. [2]
تتجزأ كل «منطقة فرعية» (A/B Compartments) في شكل هياكل أصغر تدعى «مجالات الارتباط الطوبولوجي» (Topologically Associating Domains, TADs)، حتى نصل لآخر مستويات التنظيم الرئيسية، وهي «ألياف الكروماتين» (Chromatin Fibers) التي تتشكل من وحدات بنائية أصغر تسمى «النيوكليوسومات» (Nucleosomes)، وهي عبارة عن لولب الحمض النووي المزدوج (DNA) ملتفًا حول ثمانية بروتينات تُعرَف باسم «الهستونات» (Histones). تلك البنية الهرمية المعقدة -كما هو موضح بالشكل (2)- تتيح التحكم الدقيق في آليات التعبير الجيني، بالإضافة إلى توفير هيكل مكدَّس للمادة الوراثية، بدءًا من مناطق الكرموسومات وصولًا إلى لولب الحمض النووي (DNA)، وهذا ما يفسر إمكانية تعبئة جزيء مثل هذا الحمض النووي (DNA) -طوله متران تقريبًا- فيما لا يزيد عن عشرة ميكرومترات داخل النواة. [4,5]

هويات عدة والجينوم واحد
يتركب الحمض النووي للخلية البشرية (DNA) مما يقرب من ثلاثة مليارات زوج قاعدي. كل تسلسل من تلك الأزواج يعُرَف باسم الجين ويحمل الشفرة الوراثية لتكوين بروتين ما. يبدأ تسلسل الجين من أحد الأزواج القاعدية وينتهي عند آخر، حيث تتابين أطوال الجينات بناءً على مدى تعقيد وحجم البروتين الذي تحمل شفرته الوراثية. يبدأ إنتاج البروتين بعملية «النسخ» (Transcription) التي يقوم بها الحمض النووي الريبوزي الرسول (mRNA)، وبعد أن يتم نسخ تسلسل الجين المطلوب، يخرج إلى الريبوسوم ليتحول إلى تسلسل من الأحماض الأمينية، حيث تحمل كل ثلاث قواعد من جزيء (mRNA) شفرة لأحد الأحماض الأمينية التي تبلغ 20 حمضًا أمينيًا مختلفًا، وتُعرَف هذه العملية بـ «الترجمة» (Translation)، كما هو موضح بالشكل (3).
يبلغ عدد جيناتنا القابلة للنسخ نحو 23,000 جين مشفر، وهذا العدد لا يكفي لحمل الشفرة الوراثية لكل البروتينات اللازمة لنشاط الخلية، لذا تُجرَى عدة تعديلات على البروتين بعد عملية الترجمة بإضافة بعض المركبات مثل مجموعتي الفوسفات والأسيتيل لتسلسل أحماضه الأمينية قبل بلوغه شكله النهائي [2,3]، وتُعرَف هذه العملية باسم «تعديلات ما بعد الترجمة» (Post-Translation Modifications). بهذه الطريقة تكون الخلية قادرة على إنتاج عشرات الآلاف من البروتينات التي لها أشكال متعددة، وبالتالي وظائف مختلفة.
إذًا، إن كانت آلية التعبير الجيني تتلخص في نسخ الجين ومن ثم ترجمته إلى بروتين، فما الذي يعطي هذا المدى الواسع من التمايز الخلوي، ليس عند البشر فحسب، بل لكل الأنواع عديدة الخلايا؟ يتكون الحيوان عديد الخلايا من عدة أنسجة متآزرة، تشترك بينها جميعًا بروتينات ضرورية. تعد جزيئات (mRNA) بمثابة رمز تعريفي يميز النسيج عن قرينه في نفس العضو، وعليه يمكن اعتبار أن شبكة بروتيناته الخاصة تمثل هويته الفريدة. لا تقوم الخلايا المتمايزة بالتعبير عن بروتينات جينومها بالكامل؛ ليس لأنها ليست بحاجة لذلك فحسب، بل لأن آليات تنظيم تعبيرها الجيني لا يتسنى لها الوصول إلا لمجموعات محددة من الجينات تمثل خريطة جيناتها النشطة، ويتم ذلك بـ «إعادة تشكيل كروماتين الخلية» (Chromatin Remodeling) في مراحل النمو الأولى من حياة الفرد.
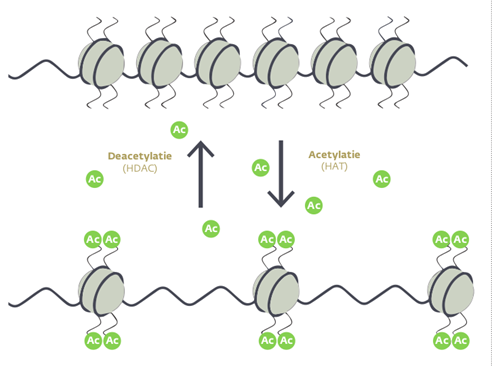
تمثل التعديلات على الهستونات مفتاح تشكيل الكروماتين، فبارتباطها بمركبات معينة مثل مجموعتي الأسيتيل والميثيل، تتغير تعبئة الحمض النووي (DNA) من الحالة المكدسة غير النشطة لتصبح أكثر انفتاحًا، وبالتالي تصبح آليات النسخ قادرة على الوصول له عند الحاجة. وبإزالة تلك المركبات، تعود الهستونات لحالتها المكدسة مرة أخرى، ولا يكون الحمض النووي (DNA) قابلًا للنسخ في هذه الحالة غير النشطة هيكليًا، كما هو موضح بالشكل (4). التعديل على الهستونات ليس الآلية الوحيدة التي تغير بنية الكروماتين، بل تشترك معها كثير من الآليات التنظيمية الأخرى، ولكن في النهاية تظل النتيجة واحدة؛ وهي أنه بتعديل بنية الكروماتين، يتم فصل جينوم الخلية إلى مناطق جينية نشطة تقترب من الوسط ويسهل الوصول لها، ومناطق غير نشطة تبتعد إلى المحيط النووي، ولذا تتشكل هوية النسيج كنتيجة للبنية الفريدة لجينوم خلاياه. [6,7]

ديناميكية التعبير الجيني
يظل التعبير الجيني للخلية أحد أهم مباحث البيولوجيا الجزيئية، ليس بفهم تركيب البروتينات المختلفة ووظائفها المتعددة فحسب، بل إنّ الأمر يمتد لفهم «المتسلسلات الزمنية التي تُفعّل فيها الخلية عملية النسخ» (Time-Series Transcriptomics) لجينات بعينها دونًا عن جينات أخرى، بالإضافة إلى المدة التي تستمر فيها عملية النسخ، وذلك بهدف إنتاج كمية محددة من بروتين ما. وعليه، يجب معرفة ما إذا كان لخلايا النسيج نمط تعبير جيني متطابق كقطيع من الروبوتات، أم أن لكل خلية سلوكًا فريدًا يناسب احتياجاتها.
بالتأكيد تشترك جميع الأنسجة في التعبير عن نفس مجموعة الجينات التي تحمل الشفرة الوراثية لبروتينات ضرورية لها جميعًا، ولكن كما أنّ لكل نسيج تنظيمًا هيكيليًا لكروماتين خلاياه، يتميز تعبيره الجيني بأنماط زمنية خاصة تحدد وقت تفعيل الجين ومدته، بناءً على احتياجاته والعلاقة التنظيمية بينه وبين الأنسجة الأخرى. وعلى نفس المنوال تظهر تحاليل مثل «تسلسل جزيء الحمض النووي الريبوزي للخلية المفردة» (Single-Cell RNA Sequencing) أنّ لكل خلية «ملفًا تعريفيًا نسخيًا خاصًا» (mRNA Profilling)، وبذلك تتابين نتيجة التحليل بين أقرب الخلايا وبعضها حتى عند نفس النقطة الزمنية، وهذا يعني أنه لا يُشترَط اشتراك خليتين من نفس النسيج في نفس السلوك الزمني للتعبير الجيني، ولا يستحيل أيضًا حدوث موجات تتزامن فيها الخلايا في التعبير عن نفس الجين كما يحدث في مراحل النمو الأولى.
عند التعبير عن بروتين مثل الإنسولين، لا تقوم جميع خلايا بيتا بالبنكرياس بإفرازه في آنٍ واحد أو بنفس الكمية، بل تفرز كل خلية كمية محددة منه بشكل متقطع، وتنسق الخلايا عملها جماعيًا لتقرر متى تتوقف ومتى تستأنف النسخ بناءً على احتياجات الجسم. يعد هذا التباين الزمني في التعبير الجيني أمرًا ضروريًا لتكيف الخلية مع بيئتها المحلية، كتلبية احتياجاتها الفردية من العمليات المختلفة مثل الأيض والانقسام، بالإضافة إلى أنّ هذا التباين يهيء الخلية للاستجابة لإشارات الإجهاد الطارئة. على سبيل المثال، عندما يُصاب السطح الخارجي لنسيج ما بالتلف -سواءً كان حرقًا أو جرحًا- تعمل الخلايا الأقرب إلى السطح على تنشيّط جينات الإصلاح بسرعة أكبر، وتفعلها لمدة أطول من الخلايا الداخلية للنسيج ذاته، التي تستجيب تباعًا بحكم بُعدِها عن موقع الإصابة. وعليه، بينما تحدد بنيةُ الكروماتين هويةَ النسيج، تحدد الأنماطُ الزمنية للتعبير الجيني الهويةَ الفردية للخلية.[8-10]
العلاج الخلوي
يحمل كلٌّ منا نوعًا من الخلايا تُعرَف بـ «الخلايا الجذعيّة» (Stem Cells). تلك الخلايا يمكنها التحول لأي نوع آخر من الخلايا الجسدية المتمايزة كالخلايا العضلية أو العصبية. عملت الأبحاث على استغلال تلك القدرة الفريدة في توجيه عملية التمايز لأحد أنواع الخلايا المختلفة، في محاكاة لما يحدث للخلايا الجنينية بمراحل النمو المبكرة؛ وتلك كانت بداية «العلاج الخلوي» (Cell Therapy). تهدف هذه العملية إلى إنتاج أنسجة تعويضية جديدة للفرد المصاب من الخلايا الجذعية للفرد ذاته، ويتجنب هذا النهج احتمالية مهاجمة الجهاز المناعي للجزء المزروع، كما يحدث في عمليات نقل الأعضاء التقليدية من فرد لآخر. ولكن هل لوجود الخلايا الجذعية في عملية العلاج الخلوي ضرورة؟ يجري العلماء كثيرًا من الأبحاث حاليًا حول تحويل الخلايا المتمايزة بالفعل لنوع خلايا آخر، فيما يُعرَف بـ «إعادة البرمجة الخلوية» (Cell Reprogramming).
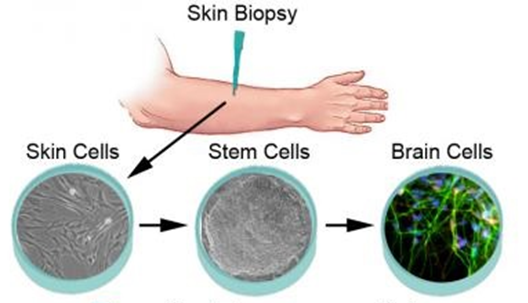
منذ ما يقارب العقدين، بيّن مجموعة من العلماء اليابانيين أنه من خلال إدخال أربعة عوامل نسخ إلى خلايا الجلد، يمكن تحفيزها لتصبح «خلايا جذعية مستحثة متعددة القدرات» (Induced pluripotent stem cells, iPSCs)، ومن ثم يمكن توجيهها للتمايز للنوع المطلوب، كما يظهر بالشكل (5)؛ إذ تتحول خلايا الجلد إلى خلايا جذعية وسيطة، وبعدها تُوجَّه لتصبح خلايا عصبية. تمثل تلك التقنية خطوة ناجحة في العلاج الخلوي، ولكنها تستغرق عدة أسابيع لتكتمل. وبسبب الإخفاقات في المراحل الوسيطة، لا تصل جميع الخلايا المحوَّلة إلى النضوج التام. لذا، يواصل العلماء الأبحاث لإيجاد تقنيات أكثر فعالية.
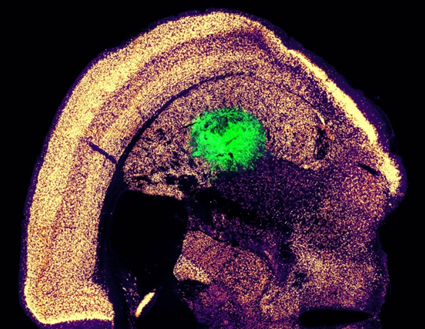
تُعرَف أحدث تقنيات العلاج الخلوي الحالية بـ «التمايز الانتقالي» (Transdifferentiation)، وتتلخص في أنه عند إضافة عوامل نسخ معينة لأحد أنواع الخلايا، يتحول مباشرةً لنوع لآخر دون المرور بحالة الخلية الجذعية. حديثًا، قام باحثان من معهد ماساتشوستس للتكنولوجيا (MIT) بفصل مجموعة خلايا من جلد فأر، ومن ثم -باستخدام فيروس معدل جينيًا- أدخلوا ثلاثة عوامل نسخ لتلك الخلايا بغرض تحويلها إلى «خلايا عصبية حركية» (Motor Neurons)، بالإضافة إلى بروتينين أخريين لتحفيز عملية التكاثر، إذ تقوم عوامل النسخ بالتغييرات اللازمة للتعبير عن جينات الخلايا العصبية المطلوبة. أثبتت تلك الطريقة أنّها قادرة على إنتاج أكثر من عشر خلايا عصبية من تحويل خلية جلدية واحدة. ولإثبات فعالية تلك الخلايا، تمت زراعتها في «الجسم المخطط» (Brain striatum) بدماغ الفأر، لتنجح في تخليق روابط عصبية جديدة مع الخلايا العصبية الأخرى، كما يظهر باللون الأخضر في الشكل (6). تلك النتائج هي ما يدفع أبحاث «الطب التجديدي» (Regenerative Medicine) لإحداث ثورة وإيجاد علاجات دائمة ومستقرة للأمراض العصبية المستعصية، مثل الشلل والتصلب الجانبي الضموري. [11,12]
قراءات إضافية:
- علم الأحياء النَّمائي: مقدمة قصيرة جدًّا : https://www.hindawi.org/books/31309046/
- استكشاف العالَم الديناميكي لعلم التخلُّق: عِلم التعبير الجيني خلف تسلسل الحمض النووي – https://library.egyptscholars.org/?p=9704
- علم ما فوق الجينات: وسيلةٌ لعلاج بعض الأورام السرطانية – https://library.egyptscholars.org/?p=10008
- هل تملك زمام جيناتك؟ –https://library.egyptscholars.org/?p=9122
المراجع:
1- الخلية: مقدمة قصيرة جدًّا – (الفصل الأول: طبيعة الخلايا) https://www.hindawi.org/books/18024131/1/
2- الخلية: مقدمة قصيرة جدا – (الفصل الثالث: النواة) https://www.hindawi.org/books/18024131/3/
3- Animal with the most genes? A tiny crustacean: https://www.sciencedaily.com/releases/2011/02/110203141812.htm
4- Image of the Day: Colorful Chromosomes: https://www.the-scientist.com/image-of-the-day-colorful-chromosomes-31845
5- Three-dimensional chromatin packing and positioning of plant genomes: https://www.nature.com/articles/s41477-018-0199-5
6- Histone modifications: https://www.abcam.com/en-us/technical-resources/guides/epigenetics-guide/histone-modifications
7- Statins and atherosclerosis: the role of epigenetics: https://www.researchgate.net/publication/284751136_Statins_and_atherosclerosis_the_role_of_epigenetics
8- Understanding Single-Cell Sequencing, How It Works and Its Applications: https://www.technologynetworks.com/genomics/articles/understanding-single-cell-sequencing-how-it-works-and-its-applications-357578
9- Temporal modelling using single-cell transcriptomics: https://pmc.ncbi.nlm.nih.gov/articles/PMC10354343/
10- Transcriptional Regulation: Molecules, Involved Mechanisms, and Misregulation: https://pmc.ncbi.nlm.nih.gov/articles/PMC6471904/
11- What can stem cells teach us about bipolar disorder?: https://michigantoday.umich.edu/2014/04/10/what-can-stem-cells-teach-us-about-bipolar-disorder/
12- MIT engineers turn skin cells directly into neurons for cell therapy:
https://news.mit.edu/2025/mit-engineers-turn-skin-cells-into-neurons-for-cell-therapy-0313