
مستقبل الأحياء المائية: تفشي الأنواع الدخيلة استجابة لتغير المناخ
بقلم: فاطمة الزهراء عبد المجيد
ما هي الأنواع الدخيلة؟
يتجدد التنوع البيولوجي طبيعيًا من خلال عمليتَي الانقراض والاستنواع(1). والاستنواع هو تشعب أنواع جديدة جينيًا ومظهريًا عن مجموعات انعزلت تكاثريًا أو جغرافيًا(2). ويزداد معدل حدوث عمليتَي الانقراض والاستنواع نتيجةً للأنشطة البشرية التي أدت إلى تغير المناخ(3). وبناءً على ذلك؛ فإنّ تغير المناخ يهدد التنوع البيولوجي بشكل كبير، ويمتد تهديده ليشمل جميع أصناف الكائنات الحية من ميكروبات ونباتات وحيوانات(4). ويُعد تفشي الأنواع الدخيلة في النظم البيئية من أكبر تلك التهديدات(5)، وتتمثل تلك الأنواع في الطفيليات أو النباتات أو الحيوانات، أو حتى بيض الحيوانات أو حبوب النباتات، التي تدخل على بيئة غير بيئتها المحلية، وتتكاثر بمعدلات أعلى من الطبيعية، وتأخذ في الانتشار من الأماكن التي دخلت عليها إلى أماكن أخرى(6). ونتيجةً لما تقدم، فإنّه من المتوقع للأنواع الدخيلة أن تزداد تحت تأثير التغيرات المناخية التي تدفعها الأنشطة البشرية، مثل الاحترار العالمي(7)، وكذلك تحت تأثير التجارة العالمية التي تساهم في نقل هذه الأنواع(8).
متى يكون النوع الدخيل غازيًا؟
ولكي يكون النوع الدخيل غازيًا أو متفشيًا، عليه أن يمر بست مراحل(9):
- المرحلة الابتدائية: وهي البيئة «المُصدرة» لهذا النوع الدخيل (Source).
- المرحلة الأولى: وهي مرحلة «النقل» عبر السفن أو غيرها من الوسائط (Transport).
- المرحلة الثانية: وهي مرحلة «الدخول»، حيث يدخل هذا النوع على بيئة ما ويستقر فيها (Introduction).
- المرحلة الثالثة: هي مرحلة «الاستيطان»، حيث يتكاثر النوع ويصبح مستوطنًا لتلك البيئة الجديدة (Establishment).
- المرحلة الرابعة: وهي تكون إما بـ «هيمنة» النوع الدخيل على البيئة التي تم استيطانها، وإما بـ «انتشاره» إلى بيئات أخرى (Dominance or Dispersal).
- المرحلة الخامسة: هي مرحلة «السيادة» في بيئات مختلفة، بأن يكون النوع مهيمنًا ومنتشرًا في ذات الوقت (Prevalence).
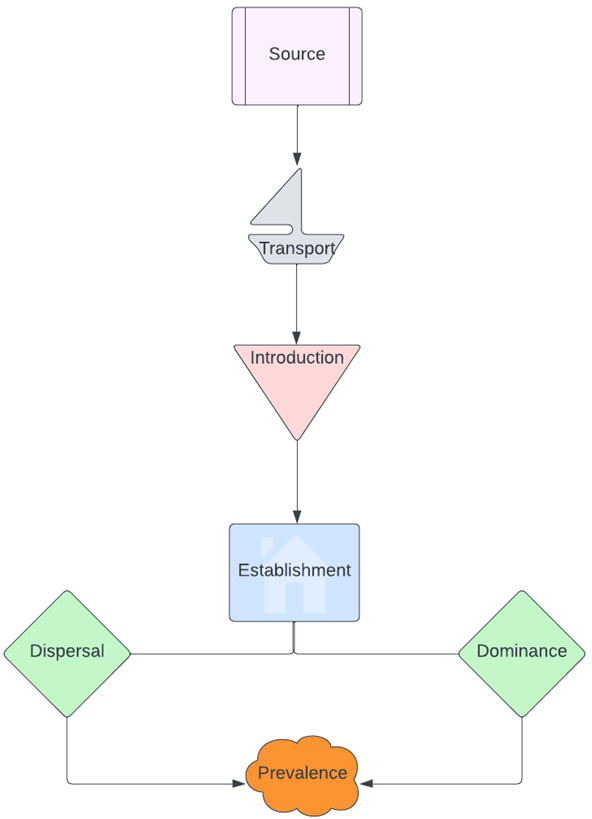
ومن شأن التغيرات المناخية المتمثلة في تغير درجات الحرارة ونُظم هطول الأمطار أن تؤثر في كل مرحلة من تلك المراحل، وبناءً عليه، تؤثر في توقيت ظهور ضرر تلك الأنواع وشدته(10). وبمجرد استيطان الأنواع الدخيلة للبيئات الجديدة، تُحدث أضرارًا جسيمةً بها من خلال إنقاص أو إبادة الأنواع المحلية، عن طريق المنافسة على الغذاء والموائل أو الافتراس أو نقل الأمراض، وإحداث اضطرابات في النظام البيئي المحلي ووظائفه(6). كما أنّها تغير التكوين الجيني للأنواع الأصلية، وتغير في سلوك الحيوانات، وتُحدث اضطرابات في الشبكات الغذائية والنظم الهيدرولوجية وبنية الموائل(6).
ولا يشترط ليكون نوعٌ ما دخيلًا أن يأتي من بلد مختلف، فقد يكون محليًا في بيئة من بيئات ذات البلد لكنّه غريبٌ عن بيئة أخرى فيه، مثل نوع من أسماك السلمون يُعد محليًا في البحيرات العظمى في أمريكا، لكنّه غريب عن بحيرة «يلوستون» (Yellowstone) فيها؛ إذ إنّه ينافس أسماك السلمون المرقط في بحيرة «يلوستون» على الموئل(11).
الأنواع الدخيلة حول العالم
في دراسة عالمية غطت نحو 49 بيئة مائية على كوكب الأرض، شملت المياه المالحة والعذبة ومصبات الأنهار، استطاع العلماء رصد 1442 نوعًا من الأنواع الدخيلة على تلك البيئات ما بين عامَي 1965 و2015، بمعدل 43 نوعًا دخيلًا في كل عام(12). وقد شكلت المفصليات والرخويات والأسماك أغلب هذه الأنواع. ويُرجح أنّ تلك الأنواع قد نُقلت متسللةً عبر مياه خزانات السفن أو عن طريق «الحشف الحيوي» (Biofouling)، وهو نمو وتراكم غير مرغوب فيهما للكائنات الدقيقة أو النباتات والطحالب والحيوانات على أسطح السفن المغمورة في المياه(13). ومع ذلك، يعتقد الباحثون أنّ ذلك العدد من الأنواع الدخيلة لا يمثل إلا قمة من جبل ضخم من الأنواع غير المرصودة بعد(12)، في حين تقدر دراسات أخرى الأنواع الغازية في المياه العذبة والمالحة بالآلاف(15،14).
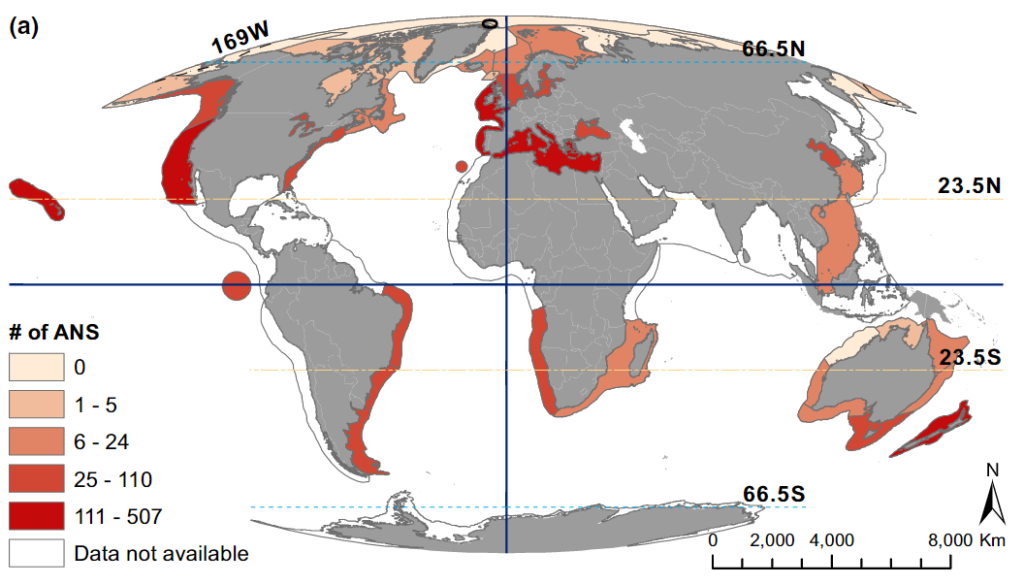
1.البحر الأبيض المتوسط
يعد البحر الأبيض المتوسط أكثر البحار التي تغزوها الأنواع الدخيلة على مستوى العالم(16). ويوضح الشكل (2) كثافةً عالية للأنواع الدخيلة في منطقة حوض البحر الأبيض المتوسط والمُبينة باللون الأحمر. ويعد افتتاح قناة السويس والتوسعة التي حدثت لها مؤخرًا بمثابة ممر بشري يسمح بدخول الأنواع المدارية من البحر الأحمر إلى البحر الأبيض المتوسط(17). ونظرًا لغياب الحواجز المادية(18) في البحر الأبيض المتوسط -كما هو الحال في المحيطات والبحار المفتوحة- ونظرًا للزيادة المتوقعة في درجات الحرارة بمقدار ثلاث درجات مئوية خلال القرن الواحد والعشرين(19)؛ فإنّ مزيدًا من الأنواع المدارية من المتوقع لها أن توسع نطاقها وتغزو البحر الأبيض المتوسط(16).
رُصدت الأنواع الدخيلة في مياه المتوسط المصرية لأول مرة عام 1924 في ساحل بورسعيد(20). وتوالت الدراسات منذ ذلك الحين لتَتبّع هذه الظاهرة(21). وفي دراسة تتبعت دخول الأنواع الغازية إلى البحر المتوسط منذ عام 1988 إلى عام 2017، رصد العلماء 957 نوعًا جديدًا(22). وأتبع الباحثون هذه الدراسة بدراسة أخرى رصدت الأنواع الغازية ما بين عامَي 2017 و2019، فتبيّنوا دخول 70 نوعًا مداريًا جديدًا إلى البحر الأبيض المتوسط(23)، ليتجاوز بذلك عدد الأنواع الغازية للبحر المتوسط الألف نوع، ما بين طحالب وعوالق نباتية ولا فقاريات وفقاريات(21).
2.القطب الشمالي
وحتى مياه القطب الشمالي لم تسلم من الأنواع الغازية على الرغم من بيئتها القاسية، حيث درس العلماء الأنواع الدخيلة في القطب الشمالي ما بين عامَي 1960 و2015، فشملت دراستهم 34 نوعًا جديدًا، أكثرهم من المفصليات ومن شعبة «الأكروفايتا» (Ochrophyta)، وهي مجموعة من الطحالب البحرية التي تعيش في نصف الكرة الأرضية الشمالي(24). وكان لـ «الجرف الآيسلندي» (The Iceland Shelf) النصيب الأكبر من تلك الأنواع، يليه «بحر بارنتس» (Barents Sea)، ثم «البحر النرويجي» (Norwegian Sea). ويعزو العلماء دخول تلك الأنواع إلى الأسباب الآتية على الترتيب من حيث الأكبر مساهمة: النواقل البحرية من السفن وغيرها، والانتشار الطبيعي بدون تدخلات بشرية، والمزارع السمكية(24).
3.«نهر الراين» (Rhine River)
أما بالنسبة إلى المياه العذبة، فقد درس العلماء في ألمانيا التغيرات التركيبية والوظيفية لنهر الراين عبر تتبع بيانات الأسماك ما بين عامَي 1984 و2018، فوجدوا زيادة في أعداد الأسماك الغازية على حساب الأسماك الأصلية(25)، حيث زادت نسبة الأنواع الدخيلة من 5% عام 1993 إلى 30% عام 2018. ومن ناحية أخرى، فقد قلّ «ثراء» (Richness) الأنواع الأصلية بنسبة 26%، كما قلت «وفرة» (Abundance) الأنواع الأصلية بنسبة 50%(25).
4.نهر النيل
وفي نهر النيل، وبعد إدخال أسماك الفرخ النيلية في «بحيرة فكتوريا» في خمسينيات القرن الماضي لتعزيز إنتاج الأسماك، زاحمت تلك الأسماك الدخيلة الأسماكَ الأصلية، حتى أوشكت أسماك البلطي على الانقراض بسببها(26). كما تفشت أسماك السلطعون النهري الأحمر في روافد نهر النيل وهيمنت عليها نتيجة التغيرات الناتجة عن الاحترار العالمي(27).

المصادر:
1. Johnson C.N., Balmford A., Brook B.W., Buettel J.C., Galetti M., Guangchun L., Wilmshurst J.M., 2017. Biodiversity losses and conservation responses in the anthropocene. Science 356 (6335), 270–275.
2. Safran, R. J. & Nosil, P. 2012. Speciation: The Origin of New Species. Nature Education Knowledge 3(10):17.
3. Faurby S, Pedersen RØ, Svenning J, Antonelli A. 2022. The counteracting effects of anthropogenic speciation and extinction on mammal species richness and phylogenetic diversity. Global Ecology and Biogeography. 31(9): 1810-1823.
4. United Nations. 2022. Biodiversity – our strongest natural defense against climate change. United Nations.
5. Seebens H, Blackburn TM, Dyer EE, Genovesi P, Hulme PE, Jeschke JM, Pagad S, Pyšek P, van Kleunen M, Winter M, et al. 2018. Global rise in emerging alien species results from increased accessibility of new source pools. Proceedings of the National Academy of Sciences. 115(10): E2264–E2273.
6. Pyšek P, Hulme PE, Simberloff D, Bacher S, Blackburn TM, Carlton JT, Dawson W, Essl F, Foxcroft LC, Genovesi P, et al. 2020. Scientists’ warning on invasive alien species. Biological Reviews. 95(6):1511–1534.
7. Bennett S., Santana-Garcon J., Marbà N., Jorda G., Anton A., Apostolaki E. T., Cebrian J., Geraldi N. R., Krause-Jensen D., Lovelock C. E., Martinetto P., Pandolfi J. M., & Duarte, C. M. 2021. Climate-driven impacts of exotic species on marine ecosystems. Global Ecology and Biogeography, 30(5), 1043–1055.
8. Seebens H., Bacher S., Blackburn T. M., Capinha C., Dawson W., Dullinger S., Genovesi P., Hulme P. E., van Kleunen M., Kühn I., Jeschke J. M., Lenzner B., Liebhold A. M., Pattison Z., Pergl J., Pyšek P., Winter, M., & Essl, F. 2021. Projecting the continental accumulation of alien species through to 2050. Global Change Biology, 27(5), 970–982.
9. Occhipinti-Ambrogi A. 2007. Global change and marine communities: Alien species and climate change. Marine Pollution Bulletin. 55(7-9):342–352.
10. Hulme PE. 2016. Climate change and biological invasions: evidence, expectations, and response options. Biological Reviews. 92(3):1297–1313.
11. The National Wildlife Federation. 2018. Invasive Species. The National Wildlife Federation.
12. Bailey SA, Brown L, Campbell ML, João Canning-Clode, Carlton JT, Nuno Filipe Castro, Chainho P, Chan FT, Creed JC, Fabrice Pernet, et al. 2020. Trends in the detection of aquatic non‐indigenous species across global marine, estuarine and freshwater ecosystems: A 50‐year perspective. 26(12):1780–1797.
13. Rao TS. 2022. Biofouling (macro-fouling) in seawater intake systems. Water-Formed Deposits.:565–587.
14. AquaNIS Editorial Board (2015). Information system on aquatic non‐indigenous and cryptogenic species. Retrieved from www.corpi.ku.lt/databases/aquanis.
15. U.S. Geological Survey (2017) Nonindigenous Aquatic Species Database. Retrieved from https://nas.er.usgs.gov.
16. Schickele A, Guidetti P, Giakoumi S, Zenetos A, Francour P, Raybaud V. 2021. Improving predictions of invasive fish ranges combining functional and ecological traits with environmental suitability under climate change scenarios. Global Change Biology. 27(23):6086–6102.
17. Öztürk, B. 2021. Non-indigenous species in the Mediterranean and the Black Sea. Studies and Reviews No. 87 (General Fisheries Commission for the Mediterranean). Rome, FAO.
18. Lenoir J, Bertrand R, Comte L, Bourgeaud L, Hattab T, Murienne J, Grenouillet G. 2020. Species better track climate warming in the oceans than on land. Nature Ecology & Evolution. 4(8):1044–1059.
19. Macias D. M., Garcia-Gorriz E., & Stips A. (2015). Productivity changes in the Mediterranean Sea for the twenty-first century in response to changes in the regional atmospheric forcing. Frontiers in Marine Science, 2, 79.
20. Fauvel, P., 1927.Rapport sur les Annelides Polyche’tes Errantes.Trans. Zool. Soc. Lond.22, 411e439. http://dx.doi.org/10.1111/j.1096-3642.1927.tb00203.x.
21. Zenetos A, Çinar ME, Crocetta F, Golani D, Rosso A, Servello G, Shenkar N, Turon X, Verlaque M. 2017. Uncertainties and validation of alien species catalogues: The Mediterranean as an example. Estuarine, Coastal and Shelf Science. 191:171–187.
22. Zenetos A. Mediterranean Sea: 30 years of biological invasions (1988-2017). In:1st Mediterranean symposium on the non-indigenous species; 2019. p. 13.
23. Zenetos A, Galanidi M. 2020. Mediterranean non indigenous species at the start of the 2020s: recent changes. Marine Biodiversity Records. 13(1).
24. Chan FT, Stanislawczyk K, Sneekes AC, Dvoretsky A, Gollasch S, Minchin D, David M, Jelmert A, Albretsen J, Bailey SA. 2018. Climate change opens new frontiers for marine species in the Arctic: Current trends and future invasion risks. Global Change Biology. 25(1):25–38.
25. Gwendaline Le Hen, Paride Balzani, Haase P, Kouba A, Liu C, L.A.J. Nagelkerke, Theissen N, Renault D, Soto I, Haubrock PJ. 2023. Alien species and climate change drive shifts in a riverine fish community and trait compositions over 35 years. Science of The Total Environment. 867:161486–161486.
26. Impact of an Invasive Species. educationnationalgeographicorg. https://education.nationalgeographic.org/resource/impact-invasive-species/.
27. Keller RP, Lodge DM, Finnoff DC (2007) Risk assessment for invasive species produces net bioeconomic benefits. PNAS 104(1):203–207.
28. Red Swamp Crayfish (Procambarus clarkii) – Species Profile. 2019. Usgsgov. https://nas.er.usgs.gov/queries/factsheet.aspx?SpeciesID=217.



